Сторінка
1
План
1. Ідеальні гази.
2 Молекули реальних газів.
3. Сили міжмолекулярної взаємодії.
3.1. Сили притягання та відштовхування.
3.2. Сили Ван-дер-Ваальса.
4. Рівняння Ван-дер-Ваальса. Все подробности hp lj 1018 картридж здесь.
4.1. Поправка на власний об'єм молекул.
4.2. Поправка на притягання молекул.
Ідеальні гази
Поняття про ідеальні та реальні гази виникло в рамках молекулярної фізики і базується на молекулярно-кінетичній теорії будови речовини. її основним твердженням є те, що всі тіла в природі складаються з дрібних частинок — атомів і молекул, які знаходяться в постійному хаотичному русі. Характер руху частинок у газах, рідинах і твердих тілах різний.
У твердих кристалічних тілах сили взаємодії між частинками дуже великі, тому молекули не можуть віддалитися одна від одної на дуже великі відстані. У результаті спільного впливу сил притягання й відштовхування частинки твердого тіла здійснюють коливання біля певних середніх положень — вузлів кристалічної решітки.
У рідинах кожна частинка протягом деякого часу коливається біля певного положення рівноваги, яке час від часу зміщається на відстань, сумірну з розміром молекули. У результаті молекули всередині рідини коливаються і повільно переміщаються.
На відміну від рідин, у яких переважає притягання частинок, у газах домінує відштовхування. Воно сильно залежить від температури, тому що вона визначає швидкість руху частинок і їхню кінетичну енергію.
Молекулярно-кінетична теорія користується ідеалізованою моделлю газоподібної речовини.— так званим ідеальним газом. Основні твердження, на які спирається ця модель, такі: *
1) власний об'єм молекул газу настільки малий у порівнянні з об'ємом посудини, що ним можна знехтувати;
2) між молекулами газу відсутні сили взаємодії;
3) зіткнення молекул газу між собою і зі стінками посудини абсолютно пружні.
Модель ідеального газу часто використовується при вивченні реальних газів. Справа в тому, що деякі гази в близьких до нормальних умовах наближаються за властивостями до ідеальних газів. Крім того, практично для будь-якого реального газу можна створити такі умови, при яких він поводитиметься як ідеальний. Звичайно це досягається за рахунок низьких тисків і високих температур. Бажання привести будь-який реальний газ до ідеального ґрунтується на тому, що для ідеальних газів установлений цілий ряд законів, що описують їхню поведінку (закони Бойля—Маріотта, Гей-Люссака, Авогадро, Дальтона).
Проте існують процеси, умови протікання яких не дозволяють привести реальний газ до ідеального. Це трапляється в промислових виробництвах, наукових дослідженнях і т. ін. Тому для опису стану реальних газів був установлений ряд закономірностей, які дозволяють вивчати їхню поведінку, не змінюючи умов проведення процесу.
Молекули реальних газів
Якщо для ідеального газу прийнято, що частинки не взаємодіють одна з одною на відстані, то в реальних газах існують сили міжмолекулярного притягання й відштовхування. Сили взаємного відштовхування молекул виявляються при зіткненні молекул газу між собою і зі стінками посудини.
При зіткненнях молекули поводяться подібно до абсолютно пружних кульок, діаметр яких залежить тільки від хімічної природи газу і називається ефективним діаметром молекули (d). Незалежно від того, який саме газ розглядається, порядок величини d залишається постійним (10-10 м).
Між кульками-молекулами діють сили взаємного притягання. Вони швидко зменшуються зі збільшенням відстані г між молекулами газу і при r>10-9м практично дорівнюють нулю. Таким чином, реальний газ наближається за властивостями до ідеального зі збільшенням середньої відстані між молекулами, тобто зі зменшенням густини газу.
Багато газів (азот, водень, гелій, кисень, повітря та ін.) можна вважати ідеальними вже при густині, що відповідає атмосферному тиску й нормальній температурі. Так, концентрація молекул газу за цих умов складає приблизно 1025 м-3 , а середня відстань між молекулами 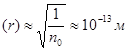 , тобто настільки велика, що силами взаємного притягання молекул можна знехтувати. Власним об'ємом молекул також нехтують, оскільки сумарний власний обсяг усіх молекул, що містяться в 1 м3 газу, складає
, тобто настільки велика, що силами взаємного притягання молекул можна знехтувати. Власним об'ємом молекул також нехтують, оскільки сумарний власний обсяг усіх молекул, що містяться в 1 м3 газу, складає
![]()
де п0 — концентрація молекул газу.
Якщо розглянути сумарну площу поверхні молекул, що містяться в 1 м3 газу, то вона дорівнюватиме:
![]()
Ця величина в багато разів перевищує площу поверхні стінок посудини. Це свідчить про те, що зіткнення молекул між собою відбуваються набагато частіше, ніж зі стінками. Тому знехтувати взаємними зіткненнями частинок так само, як нехтують власним обсягом молекул газу, не можна.
Сили міжмолекулярної взаємодії
Законам ідеальних газів підпорядковуються тільки розріджені реальні гази. У всіх інших випадках властивості ідеальних і реальних газів істотно розрізняються. Наприклад, коефіцієнт стисливості ![]() ; з рівняння Менделеева-Клапейрона для ідеальних газів завжди дорівнює одиниці, проте він залежить від тиску й температури для реальних газів. Тому при досить високих тисках усі реальні гази менш стискувані, ніж ідеальні (навіть незалежно від температури). Дослідження таких характеристик, як питома теплоємність, в'язкість і т. ін., також виявили відмінності у властивостях ідеальних і реальних газів. Основна причина цих відмінностей полягає в тому, що поведінка молекул реальних газів відрізняється від поведінки молекул ідеальних газів. В усіх тілах, незалежно від їхнього агрегатного стану, молекули взаємодіють між собою, причому сили взаємодії значною мірою залежать від відстані між молекулами. Ці сили мають електромагнітну й особливу квантову природу. У силу того, що виявляються вони на відстані
; з рівняння Менделеева-Клапейрона для ідеальних газів завжди дорівнює одиниці, проте він залежить від тиску й температури для реальних газів. Тому при досить високих тисках усі реальні гази менш стискувані, ніж ідеальні (навіть незалежно від температури). Дослідження таких характеристик, як питома теплоємність, в'язкість і т. ін., також виявили відмінності у властивостях ідеальних і реальних газів. Основна причина цих відмінностей полягає в тому, що поведінка молекул реальних газів відрізняється від поведінки молекул ідеальних газів. В усіх тілах, незалежно від їхнього агрегатного стану, молекули взаємодіють між собою, причому сили взаємодії значною мірою залежать від відстані між молекулами. Ці сили мають електромагнітну й особливу квантову природу. У силу того, що виявляються вони на відстані ![]() м і швидко зменшуються зі збільшенням відстані, їх називають короткодіючими.
м і швидко зменшуються зі збільшенням відстані, їх називають короткодіючими.
Сили притягання та відштовхування
Між молекулами речовини в будь-якому агрегатному стані діють сили взаємного притягання. Мала стисливість сильно ущільнених газів, здатність рідких і твердих тіл опиратися стисканню вказують на те, що між молекулами діють також сили взаємного відштовхування. Доведено, що сили ці діють одночасно, адже якби було навпаки, то тіла навколишнього світу не були б стійкими.
