Сторінка
3
![]()
де b — поправка Ван-дер-Ваальса, що залежить від власного об'єму молекул. Поправка і у 4 рази більша за власний об'єм всіх NK молекул одного моль газу:
![]()
Якщо об'єм вимірюється в м3, то b має розмірність м3/моль. b залежить від ефективного діаметра молекули, тобто від хімічної природи газу.
Поправка на притягання молекул
Дія сил притягання газу призводить до появи додаткового тиску на газ, що називають внутрішнім тиском. За обчисленнями Ван-дер-Ваальса, внутрішній тиск обернено пропорційний до квадрата молярного об'єму: ![]() . де а — постійна Ван-дер-Ваальса, що характеризує сили міжмолекулярного притягання.
. де а — постійна Ван-дер-Ваальса, що характеризує сили міжмолекулярного притягання.
Врахувавши всі ці поправки, ми одержуємо рівняння Ван-дер-Ваальса для 1 моль реального газу: 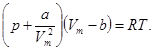
Для довільної кількості речовини v рівняння Ван-дер-Ваальса має вигляд:
![]()
де поправки а і b — постійні для кожного газу величини, що визначаються експериментально.
Виводячи рівняння, Ван-дер-Ваальс зробив ряд наближень і спрощень, тому воно не дає абсолютно точного результату, однак узгоджується з дослідом набагато краще, ніж рівняння стану ідеального газу.
СПИСОК ЛІТЕРАТУРИ
1. Кучерук І.М., Горбачук І.Т., Луцик П.П. Загальний курс фізики. Т.1. Механіка. Молекулярна фізика і термодинаміка. –К, 1999.–532 с.
2. Матвеєв О.М. Механіка і теорія відносності. –К., 1993.–288 с.
3. Сивухин Д.В. Общий курс физики: В 6 т. Т.1. Механика.–М., 1989.–520 с.
4. Іванків Л.І., Палюх Б.М. Механіка.– К., 1995.– 227 с.
5. Хайкін С.Е. Фізичні основи механіки.– К., 1966.– 743 с.
6. Кушнір Р. Курс фізики. Ч.1: Механіка. –Львів, 2000.– 196 с.
7. Савельев И.В. Курс общей физики: В 3 т. Т.1. Механика. Молекулярная физика.– М., 1987.– 416 с.
8. Иродов Н.Е. Основные законы механики.– М., 1985.– 248 с.
