Сторінка
2
Існує чітка залежність сил взаємного притягання та відштовхування від відстані між молекулами. Якісна залежність сил міжмолекулярної взаємодії від відстані г між молекулами показана на малюнку.
На дуже великих відстанях переважають сили відштовхування F0, на більш далеких — сили взаємного притягання Fn. Fрез — результуюча сила, що визначається як сума сил притягання і відштовхування, причому сили відштовхування вважаються позитивними, а взаємного притягання — негативними:
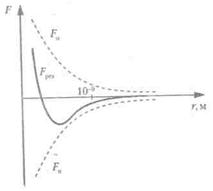
З малюнка наочно видно, що:
1) при r= r·0 результуюча сила F дорівнює нулю, тобто сили притягання й відштовхування врівноважуються. Відстань r0 відповідає такій відстані між молекулами, на якій вони перебували б за відсутності теплового руху;
2) при r<r0 переважають сили відштовхування;
3) при r > r0 переважають сили притягання;
4) на відстані r>10-9 м міжмолекулярні сили взаємодії практично відсутні • (F→0).
Сили Ван-дер-Ваальса
Сили Ван-дер-Ваальса — слабкі сили, що діють між молекулами реального: газу на відстані приблизно 10-9 м. Вони були названі по імені вченого Й. Ван-дер-Ваальса, що вперше одержав рівняння стану реального газу.
Міжмолекулярні сили мають електричну природу, тобто будь-яка взаємодія молекул насамперед обумовлена взаємодією протилежно заряджених частинок (кулонівська взаємодія). Кулонівські сили відіграють основну роль при взаємодії іонів, проте вони не можуть виникнути між нейтральними молекулами. Якщо ж ми розглянемо такі явища, як скраплення газів, флуктуація густини (тобто нерівномірний розподіл молекул в об'ємі) та ін., то стає очевидним, що між нейтральними молекулами газу відбувається взаємодія. Природа цих взаємодій фізична, а не хімічна, тому що в результаті не утворюються нові хімічні сполуки. Виходить, що навіть між незарядженими частинками може виникнути електро-, статична взаємодія. Всього існує три механізми, які пояснюють можливість цього, — три типи ван-дер-ваальсових сил.
Молекули, що вступають у взаємодію, можуть бути полярними й неполярними. У полярній молекулі центри тяжіння позитивних і негативних зарядів зміщені один щодо іншого:
![]()
Такі молекули називаються диполями. Саме наявність центрів локалізації позитивного і негативного зарядів дають полярній молекулі можливість вступати в електростатичну взаємодію або із зарядженою часткою, або з іншим диполем:
![]()
Неполярна молекула не має центрів локалізації зарядів, однак вони можуть виникнути під дією зовнішнього електричного поля. Якщо неполярна молекула достатньо наблизиться до джерела електричного поля, то воно почне діяти на атомні ядра й електрони, що входять до складу молекули: усі однойменно заряджені частинки будуть полем відштовхуватися, усі протилежно заряджені — притягатися. У результаті електричні центри тяжіння позитивних і негативних зарядів виявляться зміщеними один щодо одного та у молекулі виникне диполь. Виникнення диполя в неполярній молекулі пов'язане з її деформацією, тобто відхиленням від нормальної внутрішньої структури молекули. Найбільш стійкою для молекули структурою є та, котра спостерігається при відсутності зовнішніх впливів, тому викликаний дією зовнішнього електричного поля (індукований) диполь не буде стійким. Він зберігається лише доти, поки діє поле. Величина такого індукованого диполя буде тим більшою, чим сильніше поле і чим легше деформується молекула.
Три типи сил Ван-дер-Ваальса спираються на можливі комбінації нейтральних частинок:
— диполь — диполь;
— диполь — неполярна молекула;
— неполярна молекула — неполярна молекула. Розглянемо їх докладніше.
Нехай є дві досить близько (r < 10-9 м) розташовані одна від одної полярні молекули. У зв'язку з тим, що однойменно заряджені полюси диполів взаємно відштовхуються, а різнойменно заряджені притягаються, то обидві молекули прагнуть орієнтуватися у такий спосіб, щоб поруч опинилися різнойменні полюси (мал. 1).
![]()
Мал. 1. Схема взаємодії полярних молекул
При такому розташуванні молекул між ними діють сили притягання, які виникли за рахунок взаємодії постійних диполів. Ці сили називаються орієнтаційними. Вони змушують молекули зближуватися і міцно взаємно притягатися (мал. 2).
![]()
Мал. 2. Схема взаємодії полярної і неполярної молекул
Якщо є дві близько розташовані молекули, одна з яких полярна, а інша — неполярна, то під дією електричного поля, створюваного полярною молекулою, у неполярній утворюється диполь (мал. 2).
Подальша взаємодія відбувається аналогічно до орієнтаційної. У силу того, що диполь у неполярній молекулі індукується електричним полем полярної, то й сили називаються індукційними. Принципово інакше відбувається взаємодія двох неполярних молекул. Сили, що обумовлюють цю взаємодію, одержали назву дисперсійних, і їхню природу вдалося встановити лише в 1930 р. Нехай є два атоми інертного газу, близько розташовані один до одного (мал. 3, а).
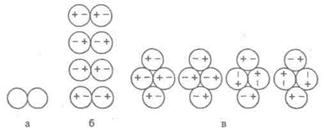
Мал. 3. Схема моделі дисперсійної взаємодії
Завдяки тому, що електрони атомів знаходяться в постійному обертанні, а ядра невпинно коливаються, то в кожному з атомів завжди може виникнути тимчасове зміщення деяких електронних орбіт щодо ядра, а услід за цим — виникнення тимчасового диполя. Кожен із таких диполів впливатиме своїми зарядами на орієнтацію подібного тимчасового диполя, виникаючого в сусідньому атомі (мал. З, б). Цей вплив буде невипадковим. Перевага віддається тій орієнтації диполів, коли межують різнойменні полюси (мал. З, в). Диполі, що виникають у такий спосіб, можуть існувати лише протягом дуже короткого часу, однак краща орієнтація частинок зберігатиметься при кожній наступній появі диполів.
Рівняння Ван-дер-Ваальса
Щоб описати стан реальних газів, необхідно врахувати розміри молекул і їхню взаємодію між собою, тому модель ідеального газу й рівняння Клапейрона—Менделєєва, що описують ідеальний газ, для реальних газів непридатні.
Враховуючи власний об'єм молекул і сили міжмолекулярної взаємодії, Ван-дер-Ваальс вивів рівняння стану реального газу, увівши поправку в рівняння Клапейрона—Менделєєва.
Поправка на власний об'єм молекул
Кожна молекула реального газу має об'єм
![]()
Тому молекули реального газу рухаються в посудині менш вільно, ніж молекули ідеального газу, власний об'єм яких прийнято за нульовий. Ван-дер-Ваальс врахував власний об'єм молекул газу шляхом заміни в рівнянні Клапейрона— Менделєєва повного об'єму судини Vm, що займає 1 моль газу, на «вільний» об'єм:
