Сторінка
3
Флотація ґрунтується на різній змочуваності водою пустої породи і мінералу. Часточки компонента, який змочується водою, поглинаються, а часточки, що не змочуються, спливають на поверхню.
Для добування металу з його сполуки, що міститься у руді, потрібно його відновити.
Найважливішим методом добування металів із руд є відновлення їхніх оксидів вуглецем або оксидом карбону (ІІ).
Відновлення металів із руд вуглецем і оксидом карбону (II) відбувається за високих температур, тому цей метод добування металів належить до пірометалургійних.
Для металів, які не відновлюються вуглецем і оксидом карбону(ІІ) (активні метали), застосовують сильніші відновники: водень, магній, алюміній, силіцій. Метод відновлення оксиду одного металу іншим металом називається металотермією (якщо відновником є алюміній — алюмотермією). Метало-термічним методом виплавляють титан, цирконій, рідкісноземельні метали, уран, хром тощо.
Для добування металів застосовують також гідрометалургійний метод, тобто електроліз водних розчинів солей та витіснення металів з їхніх розчинів іншими металами. Гідрометалургійним методом добувають золото (витіснення його з ціанідних розчинів за допомогою цинку).
Електропірометалургійним методом добувають лужні, лужноземельні метали, алюміній, титан, торій, ніобій, тантал. Суть цього методу полягає в електролізі розплавлених солей. За цим методом добувають дуже активні метали, які не можна добути, використовуючи звичайні відновники.
Сплави
У рідкому стані більшість металів розчиняється один в одному, утворюючи рідкий сплав. Сплавами називаються гомогенні суміші металів у розплавленому і затверділому станах. Затверділі сплави мають різну природу: вони можуть виявляти характер твердих розчинів, хімічних сполук, бути гетерогенними.
Щоб визначити природу сплаву, поверхню досліджують мікроскопічним методом, а також піддають його рентгеноструктурному аналізу. Проте найчастіше сплави досліджують, проводячи фізико-хімічний аналіз.
Про взаємодію між металами можна судити на підставі вимірювання питомої електропровідності систем (електропровідність окремих металів вища за електропровідність утворених ними інтерметалідів). Внаслідок взаємодії металів змінюється їхня твердість, магнітна сприйнятливість. Склад утвореного металіду можна визначити, не виділяючи його в чистому вигляді, якщо вивчати зміну однієї з названих властивостей.
Нині фізико-хімічний аналіз є основним методом вивчення природи різних сплавів. Розділ фізико-хімічного аналізу, що досліджує перетворення в системі за зміною температури її плавлення або тверднення залежно від складу, називається термічним аналізом. Діаграми температура плавлення — склад називаються діаграмами стану, або діаграмами плавлення системи. Термічний аналіз до вивчення сплавів вперше застосував у 1868 р. Д. К. Чернов, а в 1900 р. видатний російський вчений М. С. Курнаков розробив метод встановлення складу сполук у сплавах за допомогою термічного аналізу.
Для того щоб побудувати діаграму стану, досліджують експериментально криві охолодження. Розплавлений чистий метал поступово охолоджують, вимірюючи зміну температури сплаву з часом. На діаграмі температура — час дістають горизонтальну лінію, що відповідає температурі плавлення металу (затримка в охолодженні металу зумовлена виділенням прихованої теплоти кристалізації). Якщо до металу А додати метал В, то в разі поступового охолодження рідкого сплаву кристали металу А осідатимуть за нижчої температури, ніж коли б це був чистий метал. Якщо ж до чистого металу В додати метал А, спостерігатиметься аналогічна картина. Щоб побудувати діаграму стану для двохкомпонентної системи, виготовляють суміші двох чистих металів із різним їх кількісним складом, розплавляють їх і визначають температури початку кристалізації як зупинки на діаграмах температура — час (рис. 2).
Діаграми плавлення мають різну форму залежно від характеру взаємодії компонентів суміші між собою.
Якщо два метали між собою не утворюють сполуку, а в твердому стані не утворюють розчин, то діаграма стану для такої системи має так звану евтектичну точку, яка вказує на існування сплаву з найнижчою температурою плавлення. Сплав, який має таку низьку температуру плавлення, у твердому стані є сумішшю дрібних кристалів і називається евтектикою.
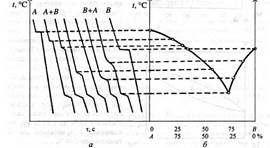
Рис. 2. Криві охолодження (а) та діаграма стану двохкомпонентної системи (б)
Термічний аналіз дає змогу виявити велику кількість сполук одних металів з іншими (інтерметалідних сполук). Такі сполуки утворюють лужні, лужноземельні метали з металами, що мають слабкі металічні властивості. Склад інтерметалідних сполук виражається формулами, в яких валентності металів не збігаються з валентностями цих металів у сполуках з неметалами. Наприклад, натрій з оловом утворює такі сполуки: NaSn4, NaSn6, NaSn3, NaSn2, NaSn, Na4Sn2, Na2Sn, Na4Sn.
Властивості сплавів відрізняються від властивостей компонентів сплаву. Температура плавлення сплаву, як правило, нижча за температуру плавлення найбільш легкоплавкого його компонента, а твердість вища, ніж твердість складових частин сплаву. Особливо сильно зростає твердість сплаву, якщо під час сплавляння утворюються хімічні сполуки металів. Високою твердістю характеризуються сплави, що містять тверді розчини. Низькі температури плавлення, висока твердість надають сплавам більшої цінності для сучасної техніки, ніж цінність металів, з яких їх виготовляють .
Традиційна форма організації навчального процесу
В системі форм навчання і виховання учнів головна роль належить уроку. Це пояснюється тим, що тільки на уроці реалізується навчальна програма.
В методиці навчання хімії за основу розподілу уроків на типи і види в різні часи обиралися різні ознаки. Так, у перші роки викладання хімії в радянській школі, коли на перший план висувався формально-логічний, або «дослідницький», метод викладання, основною формою навчання був так званий лабораторний урок. У розробці методики проведення таких уроків велика заслуга належить В. Н. Верховському.
Коли на перший план стали висувати не методи, а характер навчально-виховного процесу, типи уроків почали розрізняти за дидактичними цілями. Так, С. Г. Шаповаленко, П. О. Глоріозов, Д. М. Кирюшкін розподіляли уроки хімії на п'ять типів: вивчення нових знань, їх закріплення, узагальнення, облік і особливий тип уроку — змішаний, або комбінований. С. В. Дьякович за дидактичною метою розрізняє такі типи уроків: а) засвоєння нових знань і умінь (вивчення нового матеріалу); б) удосконалення і застосування теоретичних знань і умінь; в) узагальнення й систематизація знань; г) контрольно-облікові; д) змішані (комбіновані).
За останні роки на розробку проблеми уроку хімії великий вплив справило вчення про логіку навчального процесу, розроблене дидактами. У світлі цього вчення кожний урок хімії розглядається як завершена частина навчання, в якій виявляються властиві йому закономірності. На кожному уроці розв'язується ряд взаємозв'язаних дидактичних завдань, одне з яких є провідним, наприклад засвоєння учнями нового матеріалу, а інші — повторення знань, закріплення і узагальнення вивченого, перевірка досягнень учнів — підпорядковуються провідному завданню. Відповідно до цього будь-який урок можна розглядати як комбінований. Тому багато методистів беруть під сумнів необхідність відокремлення комбінованих уроків як особливого їх типу. Р. Г. Іванова, наприклад, враховуючи те, що для вчителя важливіше знати, чому підпорядковувати весь процес навчання на уроці, а не сам факт «комбінування» етанів уроку, його навчальних завдань, класифікує уроки хімії на три типи відповідно до головної дидактичної мети, а саме:
Інші реферати на тему «Педагогіка, виховання»:
Застосування тестового контролю навчальних досягнень учнів з теми "Хімічні реакції у 9 класі" у шкільному курсі хімії
Удосконалення естетичного виховання засобам залучення старших дошкільників до музично-театралізованої діяльності
Методика вивчення фонетики і графіки
Методика запобігання комп’ютерної залежності учнів середньої школи
Професійна орієнтація як інструмент соціалізації шкільної молоді
