Сторінка
12
• Яка роль Феруму в організмі людини? (Коротке повідомлення учня «Арифметика крові»)
• Чому концентровану H2SO4 перевозять у стальних цистернах? Скласти рівняння взаємодії Феруму з концентрованою H2SO4 під час нагрівання та розставити коефіцієнти методом електронного балансу (учні перевіряють роботи один одного й оцінюють їх).
Відповіді учнів, що працюють біля дошки (оцінює учень-рецензент).
Рольова гра «Чи знаєте ви якісні реакції». Міні-бій «Знавці хімії».
• Як визначити наявність іонів у розчинах солей: Al3t, Ca2+, Na+, K+, Cr3+, NH+4, SO42+, Fe2+, Fe3+, SO32-, NO3-, СІ-, CO32-, Zn2+?
• При аналізі бокситів необхідно встановити відсотковий уміст домішок Fe в руді. Як визначити наявність Феруму в руді і його відсотковий уміст?
• Яким одним коротким іонним рівнянням можна передати суть цих двох хімічних реакцій:
NaCI + AgNO3 →NaNO3 + AgCl↓;
ВаС12 + 2AgNO3→Ba(NO3)2 + 2AgCl↓
(Хімічні реакції записані великим шрифтом на ватмані. Після усних відповідей учнів, ведучий рольової гри показує трафарет з відповіддю.
Ag+ + Cl- → AgCl↓.
Наприкінці конкурсу кращим знавцям роздають емблеми «Лаборант»).
ІІІ. Вивчення нового матеріалу.
Девіз: «Хімік-аналітик — дуже потрібна професія)
І. Оголошення мети й теми уроку. Учитель звертає увагу учнів на те, що при розпізнаванні сполук Феруму, що має різні ступені окиснення, необхідно розрізняти розведені розчини солей: Fe2+ і Fe3+. повідомляє про використання якісних реакцій у виробництві й інших сферах діяльності людини.
Самостійне вивчення теми: «Якісні реакції на йони Fe2+ і Fe3+. (Програма-завдання лежить на кожному столі).
Нагадування: властивості сполук Феруму
KSCN-калій роданід (сіль роданисто водневої кислоти)
К3[Fe(CN)6] - калій (ІІІ) гексаціаноферат — розчинні солі.
3. Виконання лабораторної роботи з теми: «Якісні реакції на йони Fe2+ і Fe3+.
Мета роботи: вивчити характерні реакції солей феруму (ІІ) і (III).
Інструктивна картка. 1) Реакції Fe2+-ioнів з K4[Fe(CN)6] а) до розчину солі Феруму Fe3+ доливаємо K4[Fe(CN)6] — жовта кров'яна сіль (гексаціаноферат (ІІ) калію). Розчин підкислюємо 1—2 краплями соляної кислоти. У результаті реакції утвориться:
4Fe3+ + 3[Fe(CN)6]4- → Fe4[Fe(CN)6]3 (темно-синій осад берлінської лазурі застосовується для виготовлення синьої фарби);
б) реакція йонів Fe3+ з роданідом амонію:
FeCI3 + 3NH4SCN → Fe(SCN)3 + 3NH4C1,
де Fe(SCN)3 — малодисоціюючі молекули, розчин набуває криваво-червоного забарвлення;
в) реакція йонів Fe3+ з гідроксид-іонами (ОН):
Fe + 3ОН → Fe(OH)3 (буро-червоний осад).
2) реакції Fe2+-ioнів:
а) до розчину солі Fe2+ доливаємо К3[Fe(CN)6] — гексаціаноферат (III) калію (червона кров'яна сіль). У результаті реакції утвориться:
3Fe2+ + 2[Fe(CN)6]3 →Fe3[Fe(CN)6] (осад турнбулева синь);
б) реакція йонів Fe2+ з гідроксид-іонами Fe2+ + 2OH- → Fe(OH)2 (осад зеленого кольору).
Завдання
а) виконати досліди;
б) записати рівняння реакцій у молекулярному, повному йонному вигляді;
в) зробити відповідні висновки. Назвати продукти реакцій.
Варіант І - FeCl2 з K3 [Fe(CN)6];
Варіант II - FeCl3 з NH4SCN;
Варіант IIІ – FeCl2 з K4 [Fe(CN)6];
Варіант IV – FeCl2 з NaOH, FeCl3 з NOH.
IV. Підбиття підсумків уроку.
Висновки учні записують у зошити.
Які йони є якісними на йони Fe2+ і Fe3+.
Короткі повідомлення учнів про Ферум у природі.
1. Ферум у живій природі.
2. Ферум у морській воді.
3. Ферум у землі.
4. Ферум у космосі.
Методична розробка уроку з використанням лабораторних робіт на тему „Хімічні властивості металів. Електрохімічний ряд напруг металів”
Досить цікавими є уроки з використанням лабораторних робіт. Ці уроки розвивають більшу цікавість учнів до предмету. Пропонуємо розробку одного з таких уроків.
Мета уроку: Розглянути хімічні властивості металів як простих речовин з позиції знань про окисно-відновні реакції і стандартні електродні потенціали; сформувати вміння порівнювати хімічну активність металів, складати рівняння хімічних реакцій, які характеризують хімічні властивості металів; сформувати вміння використовувати електрохімічний ряд напруг металів для пояснення і передбачення реакцій між металами й розчинами солей і кислот.
Обладнання та матеріали: Періодична система хімічних елементів Д. І. Менделєєва; електрохімічний ряд напруг металів; штатив із пробірками, нагрівальний прилад, пробіркотримач; розчини ферум сульфату, цинк сульфату, купрум хлориду, розведених сульфатною і хлоридною кислотою; цинк і залізо в гранулах, мідна й залізна пластинки; рослинна олія.
Базові поняття та терміни: Метали, хімічна активність.
Тип уроку: одержання нових знань
І. Організаційний етап
II. Актуалізація опорних знань
Самостійна робота.
Самостійна робота виконується за 2 варіантами (картки 1 і 2). Замість карток 1 і 2, за допомогою яких організовується робота за варіантами, можна запропонувати загальне контролююче завдання (див. картку 3).
Картка 1
1) Наведіть два приклади реакцій взаємодії металів з неметалами і поясніть їх, виходячи з уявлень про окисно-відновні процеси.
2) Поясніть природу металічного зв'язку.
Картка 2
1) Наведіть два приклади реакцій взаємодії металів з водою, які протікають з утворенням: а) гідроксиду; б) оксиду відповідного металу. Покажіть окисник і відновник у кожній реакції.
2) Поясніть, чому метали в хімічних реакціях проявляють тільки відновні властивості.
Картка 3
1) Визначте, між якими парами речовин можливі хімічні реакції.
2) Перерахуйте, які хімічні властивості металів представлені даними рівняннями реакцій.
3) Допишіть рівняння реакцій, вказуючи окисник і відновник.
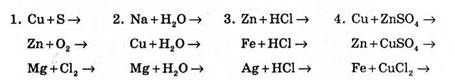
III. Вивчення нового матеріалу
1. Лабораторна робота «Взаємодія металів з розчинами кислот».
Лабораторна робота.
Виконується лабораторна робота № 5.
1) У пробірки з розведеною сульфатною кислотою поміщаються невеликі шматочки металів — міді, заліза й цинку.
2) У пробірки з розведеною хлоридною кислотою поміщаються невеликі шматочки металів — міді, заліза і цинку.
Учні записують свої спостереження, рівняння реакцій і роблять висновки про здатність металів взаємодіяти з розчинами кислот і відновлювати Гідроген.
2. Лабораторна робота «Порівняння хімічної активності металів».
Лабораторна робота.
Виконується лабораторна робота № 6.
1) Порівняння хімічної активності заліза й цинку: у пробірку з розчином сульфату заліза поміщаються гранули цинку, у пробірку з розчином цинк сульфату поміщається залізна пластинка.
2) Порівняння хімічної активності Купруму й Феруму: у пробірку з розчином купрум хлориду поміщається залізна пластинка, у пробірку з розчином ферум сульфату поміщається мідна, пластинка.
Учні записують свої спостереження, рівняння реакцій і роблять висновки про активність вивчених металів — Купруму, Феруму й Цинку.
