Сторінка
4
Історія та призначення NetLogo
NetLogo - програмоване навколишнє середовище моделювання для того, щоб моделювати природні і соціальні явища. Воно було створено Урі Віленськім в 1999 і знаходиться в безперервному розвитку в Центрі Зв'язаного Вивчення та Машинного Моделювання.
NetLogo застосовують, щоб змоделювати складні системи, що розвиваються протягом довгого часу. Модельєри можуть дати інструкції сотням або тисячам «агентів» незалежно. Це дозволяє дослідити зв'язок між поведінкою мікрорівня людей та зразками макрорівня, які з'являються з взаємодії багатьох людей. NetLogo дозволяє студентам відкриті моделювання та «гру» з ними, досліджуючи їх поведінку при різних умовах. Це також створює навколишнє середовище, яка дозволяє студентам, вчителям і розробникам навчального плану створити свої власні моделі. NetLogo досить простий, що студенти та вчителі можуть легко управляти моделювання або навіть побудувати їх власне. І він достатньо потужний, щоб служити сильним інструментом для дослідників у багатьох областях. У NetLogo є велика документація та навчальні програми. Це також йде з Бібліотекою Моделей, яка є великою колекцією моделювань, які можуть використовуватися і змінюватися. Ці моделювання відповідають багатьом областям у природничих науках та суспільних науках, включаючи біологію та медицину, фізику і хімію, математику та інформатику, економіку і соціальну психологію. Декілька, заснованих на моделі, навчальних планів запиту, використовуючи NetLogo, в даний час розвиваються.
NetLogo може також запропонувати інструмент participatory - моделювання класної кімнати в дію по імені HubNet. За допомогою мережевих комп'ютерів або переносних пристроїв, таких як Інструмент Техасу, що зображують калькулятори у вигляді графіка, кожен студент може управляти агентом в моделюванні.
Аналіз найбільш поширених помилок учнів при складанні реакцій йонного обміну в йонно-молекулярному вигляді
Методика проведення експерименту
У експерименті приймали участь учні 9Б та 9Г класів з Ліцею Інформаційних Технологій, 9Б та 9А - з Дніпродзержинської гімназії № 11. Учні, віком 13-14 років, робили невелику самостійну роботу на тему «Складання реакцій йонного обміну в йонно-молекулярному вигляді».
Учням було запропоновано вирішити такі рівняння:
MgSO4 + H3PO4 →
MgSO4 + NaOH →
MgSO4 + Na2CO3 →
Na2CO3 + HCl →
дисоц. NaOH →
NaOH + HCl →
CuSO4 + NaOH →
Cu(OH)2 + HCl →
CuSO4 + BaCl2 →
K2CO3 + HCl →
NaOH + H2SO4 →
Час на цю роботу з виконанням дослідів складав 40 хвилин. Роботи учнів були перевірені. Після цього була створена таблиця найтиповіших помилок серед усіх учнів, відсоткове відношення робіт та створені графіки.
Результати аналізу найбільш поширених помилок учнів при складанні реакцій йонного обміну в йонно-молекулярному вигляді.
На Рис. 1 зображена таблиця помилки учнів у відсотках.
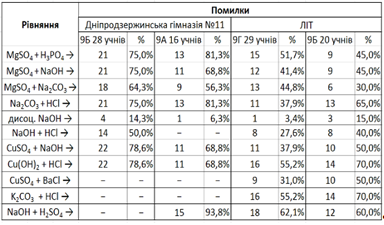
Рис. 1 Помилки у відсотках
На Рис. 1 бачимо, що помилок у рівняннях багато. Найменше помилок було зроблено у рівнянні дисоціації NaOH.
Перевіряючи роботи, були знайдені такі найпоширеніші помилки:
1. Невірно стоять коефіцієнти в молекулярній та в йонних формах.
2. Невірно складені формули продуктів реакції( не враховані валентності, заряди йонів).
3. Пропущені коефіцієнти перед катіонами в повній та йонній формах.
4. Пропущені коефіцієнти перед аніонами.
5. Пропущені коефіцієнти в скороченій йонній формі.
6. Написаний розпад на йони нерозчинної речовини, яка є продуктом реакції.
7. Написано розпад на йони нерозчинної речовини, яка є вихідною речовиною.
8. Не враховано, що H2CO3 розпадається на Н2О і СО2.
9. Пропущені заряди йонів.
10. Невірні заряди йонів стоять.
11. В скороченій йоній формі першим стоїть не катіон.
12. Пишуть, що розчинені речовини не розпадаються на йони.
13. Індекс йона SO4- пишуть коефіцієнтом в рівнянні.
14. ОН-групу не беруть у дужки.
15. Не скорочують однакові йони в скорочених йонних рівняннях.
16. Плутають хімічні елементи.
17. Не ставлять стрілочки «↓» та «↑» після формул нерозчинних речовин та газів відповідно.
На Рис. 2 зображена таблиця типових помилок знайдених під час перевірки самостійних робіт та їх кількість.

Рис. 2 Типові помилки учнів та їх кількість
Ці сімнадцять помилок можемо об’єднати у загальні три.
Невміння писати формули.
Невміння писати реакції, незнання як дисоціюють речовини, розпізнати сильні та слабкі електроліти.
Помилки в написанні йонно-молекулярного рівняння (стрілки,скорочення, знаки).
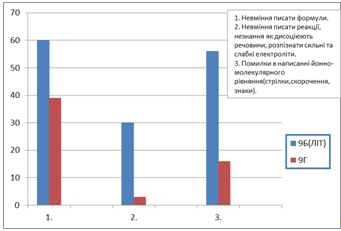
На Рис. 3 зображено три типові помилки та їх кількість.
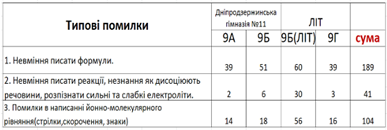
Рис. 3 Три типові помилки
З діаграми 1 видно, що найбільше помилок у 9Б класу Дніпродзержинської гімназії №11.
Якщо порівнювати класи у ЛІТі, то найбільше помилок у 9Б класу (Діаграма 2).
Діаграма 2 ЛІТ
На діаграмі 3 показано, що найбільше помилок у 9Б класу, у ЛІТі. На другому місці 9Б клас, гімназія, на третьому - 9Г ЛІТ, четверті - 9А, гімназія.
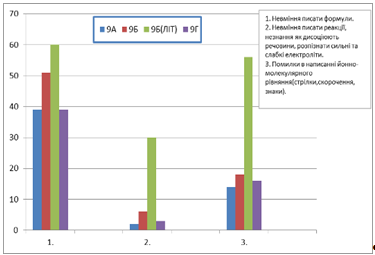
Діаграма 3 ЛІТ та Дніпродзержинська гімназія №11
Якщо порівнювати кількість зроблених помилок, то отримаємо діаграму 4. На ній ми бачимо, що найпоширеніша помилка з наведених трьох, це перша "Невміння писати формули".
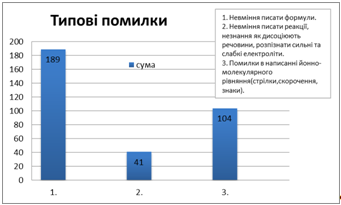
Діаграма 4 Кількість помилок
Використання моделювання при вивченні органічної хімії за програмою «Органічна хімія. 10-11 клас. Транспортні системи»
Моделювання гіпотези гібридизації.
На Рис. 1-8 представлені скріншоти слайдів параграфу 4 «Метан» електронної програми, на яких пояснюється гіпотеза sp3- гібридизації орбіталей атомів Карбону молекули метану.
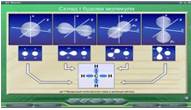

Рис.1 Рис.2


Рис3 Рис.4


Рис.5 Рис.6


Рис.7 Рис.8
На Рис. 9- 16 представлені скріншоти слайдів параграфу 11 «Етилен. Гомологи етилену», на яких методом моделювання розкривається поняття sp2-гібридизація атомів Карбону в молекулі етилену, утворення σ- та π-зв’язків, поняття подвійного зв’язку.