Сторінка
5
Рис.9 Рис.10


Рис.11 Рис.12


Рис.13. Рис.14
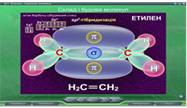

Рис.15 Рис.16
В параграфі 13 «Ацетилен. Гомологи ацетилену» методом моделювання розкривається поняття потрійного зв’язку, sp – гібридизації атомних орбіталей Карбону в молекулі ацетилену.
В параграфі 14 «Бензен» розкривається поняття циклічних молекул, утворення спряженої 6π-електронної хмари в молекулі бензену, продовжується формування в учнів поняття sp2-гібридизації . На Рис. 17-20 представлені скріншоти слайдів цього параграфу.
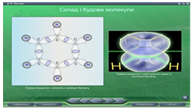

Рис.17 Рис.18
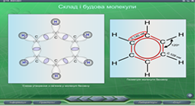
Рис.19
Моделювання явища ізомерії.
В параграфі 5 «Склад і будова алканів» використано моделювання для пояснення явища ізомерії на прикладі створення кулестержневих моделей молекул ізомерів пентану. На Рис. 21-22 представлені скріншоти слайдів даного параграфу.


Рис.20 Рис. 21
Моделювання процесів протікання хімічних реакцій.
В параграфі 7 електронного підручника методом моделювання представлена реакція взаємодії метану із хлором при освітлені ультрафіолетом, яка протікає з вибухом, що робить неможливим проводити її для демонстрації учням в кабінеті хімії під час навчального процесу.
Для усвідомлення процесу добування алканів за реакцією Вюрца в параграфі 8 «Добування і застосування алканів» використовується метод моделювання. На Рис. 23-24 представлені скріншоти даного процесу.


Рис.22 Рис.23
В параграфі 11 «Етилен. Гомологи етилену» змодельована реакція добування етилену дегідратацією етанолу (Рис. 25) та якісна реакція на π- зв'язок при пропусканні етилену через розчин калій перманганату (Рис. 26).

Рис. 24
Моделювання механізмів хімічних реакцій.
В параграфі 7 «Хімічні властивості алканів» та 11«Етилен. Гомологи етилену» методом моделювання пояснюється вільно-радикальний механізм реакції заміщення на прикладі галогенування насичених вуглеводнів (Рис. 27-28) та відповідно йонний механізм протікання реакцій приєднання до π-зв’язку ненасичених вуглеводнів (Рис. 29-30).
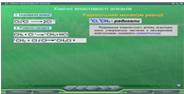

Рис. 25 Рис. 26

Рис. 27
2.3 Використання моделювання при вивченні хімії за програмою «Хімія, 9 клас»
На Рис. 1-4 наведений приклад використання комп´ютерного моделювання в хімії у школі. Приклад наведений з програми «Хімія, 9 клас», урок № 4 «Спроби класифікації хімічних елементів. Поняття про лужні метали».


В уроці № 40 «Реакції обміну між розчинами електролітів» також бачимо приклад моделювання, який допомагає учню візуально уявити хімічні реакції, а також більш детальніше зрозуміти суть реакції.

На Рис. 8-16 можемо побачити візуалізацію реакції між Pb(NO3)2 та KI. Цей урок допомагає учням більш чітко зрозуміти йонно-молекулярне рівняння та навчитися його правильно писати.
На Рис. 17-18 в уроці № 3 «Основні закономірності хімічних реакцій» за допомогою моделювання можна побачити, як рухаються молекули та атоми в різних умовах(тиск, нагрівання) та вивчити вплив тиску та температури на стан хімічної рівноваги за принципом Ле Шательє.

На Рис. 19-20 зображена модель розщеплення радіоактивного випромінювання на три пучки α, β, γ із уроку №8 «Поняття про радіоактивність та будову атома».

В уроці № 12 «Рух електронів у атомі» учні можуть візуалізувати планетарно-квантову модель атома Резерфорда – Бора та зрозуміти поняття «спін електрона», яке важко сприймається більшістю учнів.


На Рис. 23-28 в уроці № 24 «Йонний зв´язок» та в уроці № 23 «Полярний ковалентний зв´язок» наведені моделі молекули хлору та механізм утворення йонного зв’язку та кристалічної ґратки натрій хлориду.
На Рис. 29-31 зображені моделі атомних та молекулярної кристалічних ґраток, які розглядаються в уроці № 25 «Кристалічні ґратки. Атомні, йонні та молекулярні ґратки».

На Рис. 32-35 моделюється процес розчинення речовини та механізм процесу дисоціації натрій хлориду при розчиненні у воді. Урок № 32 «Процес розчинення. Його фізико-хімічна суть. Залежність розчинності від різних чинників. Поняття про кристалогідрати».
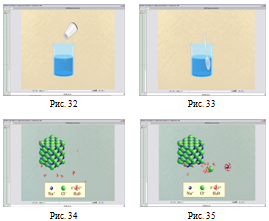
На Рис. 36-41 можемо побачити як продовжується формування поняття про процес розчинення та поняття «Гідратація». Урок № 32 «Процес розчинення. Його фізико-хімічна суть. Залежність розчинності від різних чинників. Поняття про кристалогідрати».
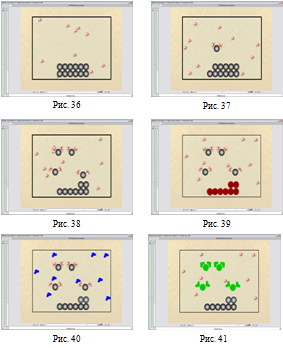
В уроці № 33 «Будова молекули води. Вода як полярний розчинник. Роль води як розчинника у живій природі» за допомогою моделювання учні з´ясовують, які особливості будови молекули води зумовили її здатність бути універсальним розчинником, продовжується формування поняття про процес дисоціації. На Рис. 42-46 зображено процес моделювання з цього року.
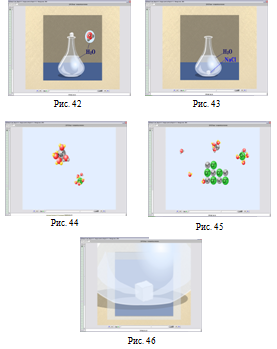
Моделювання, яке представлено на Рис. 47-56 в уроці № 47 «Хімічні властивості металів», допомагає учням поглибити свої знання про хімічні властивості металів на прикладі взаємодії металів із розчинами кислот та солей менш активних металів.

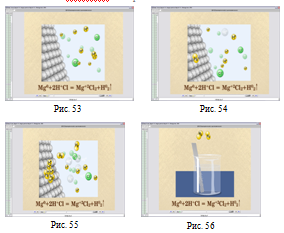
В уроці № 50 «Електроліз розплавів солей та лугів, його суть» за допомогою моделювання розглядається суть електролізу розплаву NaCl.
Інші реферати на тему «Педагогіка, виховання»:
Формування пізнавального інтересу в учнів на уроках зоології
Робота майстра виробничого навчання з сім'єю учня
Використання методів активного навчання на семінарських заняттях при вивченні дисципліни "Семіотика культури"
Стан та розвиток професійно-технічних навчальних закладів швейного профілю в Україні в 1958-2008 рр
Організація роботи професійної та психологічної студії в закладах нового типу з метою формування професійної компетентності педагогічних працівників та соціальної компетентності школярів
