Сторінка
7
Отже, структура льоду — це тривимірна сітка, подібна до структури алмазу. Збільшення густини за плавлення льоду і нагрівання води до + 4°С пояснюють зменшенням стабільності структури водневих зв’язків і їхнім викривленням. Отже, зі зменшенням міжатомної відстані Н—О—Н густина збільшується, але дальший нагрів послаблює міжатомні зв’язки, що знижує густину.
Однак такого популярного уявлення про міжатомні й міжмолекулярні зв’язки у воді замало для наукового пояснення унікального комплексу її властивостей (табл. 16).
Зі шкільного курсу хімії нам відомо, що вода в процесі електролізу розкладається на водень і кисень. Це пояснюється дисоціацією частини іонів води з утворенням протилежно заряджених іонів: Н2О → Н+1 + ОН–1. Звернімо увагу, що іон Н+1 являє собою протон.
То до якого класу хімічних речовин належить вода? Відповідно до наявності іону Н+ — вода є кислотою, водночас іон ОН– зумовлює її належність до лугів. Згідно з теорією Брестеда–Лоура вода є і кислотою і лугом, проявляючи в більшій мірі ту чи ту якість залежно від умов. Така властивість речовин має назву амфотерність (від гр. αμφοτερος — один і другий, обидва). Отже, вода є амфотерною речовиною: вона може виступати як донор протонів, тобто як кислота, або як акцептор протонів — основа. Наприклад, якщо у воді розчиняти хлорид водню, то його молекули повністю дисоціюють, утворюючи сильну кислоту (соляна кислота) НСl → H+ + Cl–. Оскільки молекули Н2О, як показано було вище, являють собою диполі, то іони Н+ (протони), утворені за дисоціації НСl взаємодіятимуть із негативно зарядженим полюсом молекули води з боку кисню, утворюючи позитивно заряджені іони гідроксонію:
![]()
![]()
![]()
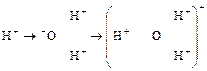 .
.
Гідроксоній
Отже, у водних розчинах іон водню існує в гідратованій формі гідроксонію.
Загальне рівняння розчинення хлориду водню у воді записують так:
![]() HCl + H2O H3O+ + Cl–.
HCl + H2O H3O+ + Cl–.
У цьому прикладі вода виступає як акцептор протонів, тобто як основа.
Другий приклад відображає умови, які утворюються за розчинення у воді слабкої кислоти, наприклад етанової (оцтової води), яка лише частково дисоціює до певного стану рівноваги:
![]() СН3СООН + Н2О Н3О+ + СН3СОО–.
СН3СООН + Н2О Н3О+ + СН3СОО–.
І в цьому разі вода зв’язує протони кислоти, виступаючи як акцептор.
За розчинення в воді сильних основ, наприклад гідроксиду натрію — NаОН, він повністю дисоціює на іони Nа+ і ОН–. Тут вода виступає вже як донор протонів, віддаючи іони Н+ гідроксид-іонам, які утворилися за дисоціації гідроксиду натрію:
![]()
![]()
У разі розчинення у воді слабкої основи, наприклад аміаку, відбувається такий самий процес — вода виступає як донор протонів, але на відміну від першого, акцептором протонів стає сам аміак:
![]()
![]() .
.
Остання реакція має важливе значення в біологічних процесах, кругообігу азоту, в технології виробництва азотних добрив та їх раціонального використання в сільському господарстві.
Відносно наведених вище реакцій самоіонізації води слід зауважити, що за нормальної температури (25°С) частка молекул Н2О, яка перебуває в іонізованому стані, надзвичайно мала: одна на 5 млрд. Однак ця здатність води утворювати іони саме в такій кількості відіграє надзвичайно важливу роль у різноманітних біологічних процесах. Дисоціація води зумовлює гідроліз слабких органічних кислот, лугів і солей. Концентрація іонів водню Н+ і також концентрація ОН– є важливою характеристикою водних розчинів. Звернімо увагу на унікальність іона Н+ — це єдиний природний іон, який не має електронів, отже, це «вільний» протон (нуклід ядра з позитивним зарядом). Жодний інший атом з періодичної системи елементів у хімічних реакціях не утворює протона.
А в чому особливість іона водню — протона? Передовсім протон, порівняно з атомом водню, а тим більше з будь-яким іншим атомом, практично не має об’єму, оскільки радіус протона (10–15 m) у 10 тисяч разів менший за радіус найменшого атома періодичної системи — атома водню. Зрозуміло, що він може безперешкодно «мандрувати» серед інших атомів. Лише його позитивний заряд заважає йому пройти поблизу негативно заряджених іонів. Як видно з табл. 16 властивостей води, вона погано проводить електричний струм, що підтверджує низьку концентрацію дисоційованих молекул води. Як їх визначають? На практиці показником концентрації Н+ і ОН– іонів є так званий водневий показник рН.
Водневий показник є кількісною характеристикою кислотності водневих розчинів і обчислюється, виходячи з константи дисоціації води. Як відомо, константа дисоціації — це відношення добутку концентрацій іонів до концентрації недисоційованих молекул. У нашому випадку:
![]() , де [Н+], [ОН–] і [Н2О] відповідно концентрації іона водню, гідроксид-іона і молекул води. Як ми вже підкреслювали, кількість дисоційованих молекул води (1 до 109) така мала, що концентрація недисоційованих молекул практично дорівнює загальній концентрації води. Узявши об’єм води 1 літр (1000g), визначимо в ньому кількість молей води: 1000 : 18 = 55,5 mol/l. Звідси, перетворивши попереднє рівняння у
, де [Н+], [ОН–] і [Н2О] відповідно концентрації іона водню, гідроксид-іона і молекул води. Як ми вже підкреслювали, кількість дисоційованих молекул води (1 до 109) така мала, що концентрація недисоційованих молекул практично дорівнює загальній концентрації води. Узявши об’єм води 1 літр (1000g), визначимо в ньому кількість молей води: 1000 : 18 = 55,5 mol/l. Звідси, перетворивши попереднє рівняння у ![]() , отримаємо ліворуч сталу величину, яка дорівнює саме добутку концентрацій іонів водню і гідроксил-іонів. Позначають її
, отримаємо ліворуч сталу величину, яка дорівнює саме добутку концентрацій іонів водню і гідроксил-іонів. Позначають її ![]() і називають іонним добутком води.
і називають іонним добутком води.
Концентрацію Н+ визначають за термодинамічною активністю іонів Н+ у розчині (у mol/l) або обчислюють за величиною електропровідності води. За 25°С концентрація Н+ дорівнює 10–7 mol/l. Отже, іонний добуток води ![]() .
.
Очевидно, що у чистій воді концентрація іонів Н+ і ОН– однакова і кислотність буде нейтральною. У розчинах, які містять кислоти, концентрація іонів Н+ підвищиться, наприклад, до 10–5 mol/l, а оскільки ![]() , то концентрація гідроксил-іона понизиться до 10–9 mol/l. За додавання до чистої води лугу матимемо зворотний результат: збільшиться концентрація іонів ОН– і зменшиться концентрація Н+. Отже, для характеристики концентрації іонів Н+ і ОН– досить визначити концентрацію тільки одного з них.
, то концентрація гідроксил-іона понизиться до 10–9 mol/l. За додавання до чистої води лугу матимемо зворотний результат: збільшиться концентрація іонів ОН– і зменшиться концентрація Н+. Отже, для характеристики концентрації іонів Н+ і ОН– досить визначити концентрацію тільки одного з них.
Інші реферати на тему «Технічні науки»:
Проект відділення обробки щитових заготовок на виготовлення шафи для посуду
Загальна економічна та екологічна характеристики сучасних систем галузевих технологій економіки
Проект змієвикового теплообмінника для охолодження цукрового розчину продуктивністю 1800 кг/год
Засоби механізації складальних операцій
Предмет «Екологія і економіка» та його загальноосвітні основи
