Сторінка
6
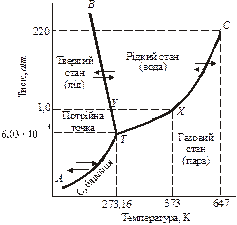
Експериментальні дані впливу температури і тиску на агрегатний стан води можна зобразити за допомогою фазової діаграми (рис. 22).
|
Рис. 22. Фазова діаграма води |
За будь-яких значень температури і тиску, які відповідають точкам діаграми в площі, обмеженій кривими ВТ і СТ, вода існує тільки в рідкому стані, у точках нижче кривої АТ і у точці Т — у вигляді пари. Точки на кривих відповідають умовам, за яких дві суміжні фази перебувають у рівновазі. Дві точки на діаграмі особливо цікаві. Точка Т (273,16 К і 6,03 · 10–3 atm) називається потрійною точкою, де в рівновазі перебувають одночасно три фази: пара, вода і лід. Точка С (647 К і 220 atm) називається критичною. За температури, більшої за 647 К, водяну пару не можна перетворити на рідину за будь-якого підвищення тиску. Інакше кажучи, за температури і тиску, вищих ніж у точці С, водяна пара й рідка вода не розрізняються. Між ними не існує фазової межі. Діаграма стану води відіграє виключно важливу роль у вивченні природних процесів біосфери, за проектування й експлуатації парових котлів, енергетичних турбін, енергосистем, автоклавів тощо.
Аномальною характеристикою води є й те, що максимального значення густини вона набуває за охолодження її у рідкому стані до + 4°С (r = = 1000 kg/m3) (табл. 16). За дальшого охолодження аж до замерзання густина зменшується. Отже, за такої самої маси об’єм льоду більший ніж води, завдяки чому крига не тоне у воді. Ця специфічна властивість забезпечує існування водяної флори і фауни, оскільки річки, озера, моря і океани ніколи не промерзають до самого дна. Пояснення цієї унікальної аномалії слід шукати у змінах структурно-хімічної будови води за змін агрегатного стану.
Молекули води, маючи значний дипольний момент, можуть взаємодіяти одна з одною, утворюючи так звані водневі зв’язки. Однак у фазі пари вода в основному одномолекулярна: атоми водню і кисню зв’язані ковалентно. У рідкому і твердому станах кожна молекула утворює чотири водневі зв’язки, з яких два — як донор протонів (Н+1) і два — як акцептор протонів. Усі чотири водневі зв’язки молекули води спрямовано (рис. 23) приблизно до вершин правильного тетраедра (або перехресних кутів протилежних граней куба).
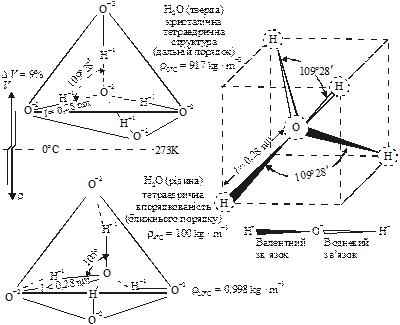
Рис. 23. Структурна схема міжатомного зв’язку кисню і водню води
Таблиця 16
ПАРАМЕТРИ ВОДИ (ХІМІЧНО ЧИСТОЇ)
| Назва | Позначення і одиниці | Розмір |
|
Температура кипіння | Ткип, | 373 (100) |
|
Температура плавлення | Тпл, | 273 (0) |
|
Температура критична | Tкрит, | 647 (374) |
|
Тиск критичний | Ркрит, МРа (атм) | 22,06 (220) |
|
Густина критична | dкрит. kg/m3 | 322 |
|
Ентальпія плавлення | ΔНпл. kJ/mol3 | 6 |
|
Ентальпія сублімації льоду за 273 К | ΔНcубл. kJ/mol | 51 |
|
Ентальпія випаровування | ΔНвип. KJ/mol | |
|
за 273 … 293 К | 44,63 | |
|
за 373 К | 40,66 | |
|
Густина льоду (тверда фаза) | ρтв. kg/m3 | 917 |
|
Густина води (рідина) за 293 К (20°С) | ρрід. kg/m3 | 998 |
|
Густина max 281 К (4°С) | — " — | 1000 |
|
Густина пари за 393 К (20°С) | ρпар. kg/m3 | 1,12 |
|
Теплоємність води за 293 К (20°С) |
| 75,34 |
|
Вода (пара) за 373 К (100°С) | — " — | 36,64 |
|
Теплопровідність льоду за 273 К (°С) | MW / (m · K) | 2,346 |
|
Рідини за 293 К (°С) | — " — | 598 |
|
Електроопір: за 293 К (20°С) | ρ, Ω · m | 18,9 · 10–6 |