Сторінка
11
Але дальші намагання вдосконалити систему за «законом октав» не мали успіху. Справді, розміщення в одній групі (по вертикалі) фосфору і марганцю, сірки й заліза не узгоджувалось з принципом подібності їхніх властивостей. Нині ми знаємо, що тільки елементи першого, другого і третього періодів відповідають принципу «закону октав». Але сучасники Д. Ньюлендса, критикуючи його, відкинули навіть саму ідею побудови таблиці, саркастично запитуючи вченого на засіданні Лондонського хімічного товариства, чи не спробував він, бува, розмістити елементи в алфавітному порядку? На жаль, такі випадки в історії розвитку науки непоодинокі. Може, так сталося ще й тому, що Джон Ньюлендс був молодою людиною і займав дрібну посаду звичайного хіміка-аналітика на цукровому заводі. Зверніть увагу на ідею побудови таблиці Ньюлендса і її сучасний вигляд: та сама октава — вісім груп і, навіть, майже через сто років перший елемент — водень, як і в Ньюлендса, стоїть над фтором.
Трохи раніше (1864) німецький хімік Лотар Мейєр у книзі «Сучасна хімічна теорія» дав свій перший варіант періодичної системи з 28 елементів, а 1869 р. — розширений другий варіант уже з 57 елементами. Він наочно продемонстрував періодичність такої характеристики елемента, як атомний об’єм:
![]() .
.
Графік такої залежності зображено на рис. 25.
Коли Мейєр працював над своєю таблицею і графіком періодичності атомних об’ємів і властивостей елементів, професор Петербурзького університету Д. І. Менделєєв відвідав наукову конференцію, на якій відомий італійський хімік Канніццаро розповсюджував копії своєї найбільш повної на той час таблиці атомної ваги елементів. Працюючи
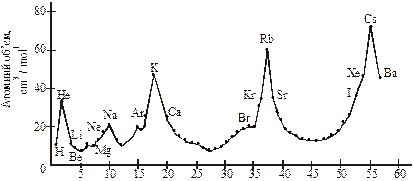
Рис. 25. Залежність періодичності атомних об’ємів елементів від їхніх атомних мас (Л. Мейєр, 1869)
над підручником «Основи хімії», Д. І. Менделєєв відчував гостроту потреби в систематизації хімічних елементів. Творчо аналізуючи відому на той час кореляцію між властивостями елементів і їхніми атомними масами, він досяг поставленої мети і 1869 року опублікував свою першу знамениту Періодичну таблицю з відомих на той час 45 елементів (табл. 19). Геніальність Д. І. Менделєєва проявилась у тім, що він розглядав періодичність властивостей елементів не за формальними ознаками, а як виявлення законів природи. Про це свідчить той факт, що коли в таблиці наступний в періоді за атомною масою елемент не відповідав властивостям групи, Менделєєв переносив його в наступну групу, передбачаючи, що пропущене місце займе елемент, який іще просто не відкрито! Справді, три такі елементи — скандій, галій і германій — було пізніше відкрито й розміщено на належних місцях.
Таблиця 19
ПЕРІОДИЧНА ТАБЛИЦЯ МЕНДЕЛЄЄВА (1869 р.)
|
Період |
Групи | |||||||
|
І |
ІІ |
ІІІ |
IV |
V |
VI |
VII |
VIII | |
|
1 |
H | |||||||
|
2 |
Li |
Be |
B |
C |
N |
O |
F | |
|
3 |
Na |
Mg |
Al |
Si |
P |
S |
Cl | |
|
K |
Ca |
* |
Ti |
V |
Cr |
Mn |
Fe Co Ni | |
|
4 |
Cu |
Zn |
* |
* |
As |
Se |
Br | |
|
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
* |
Ru Rh Pd | |
|
5 |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I | |
Крім цього, Д. І. Менделєєв, як і раніше Ньюлендс, дотримуючись основної мети систематизації елементів за властивостями, навіть порушив принцип їхнього розміщення за збільшенням відносної атомної маси: елемент телур (в. а. м. 27,6) він помістив у таблиці попереду елемента з меншою відносною атомною масою — йоду (в. а. м. 26,9). Як пізніше з’ясувалось, це був непоодинокий випадок. Саме з таким порушенням принципу збільшення атомної маси в сучасній таблиці розміщено пари елементів: Ar (39,94) i K (39,1), Co (58,9) i Ni (58,7) та деякі інші.
У зв’язку з цим виникає питання, чи є атомна маса елемента фундаментальною основою періодичного Закону? Об’єктивно в часи Лотара Мейєра і Д. І. Менделєєва на таке питання відповіді не було, бо ще не було умов для виявлення саме фундаментальної основи періодичності елементів: будови атома.
Остаточно Періодичний закон хімічних елементів було сформульовано 1914 р. після геніального відкриття молодим англійським фізиком Генрі Мозлі (1887—1915) залежності між довжиною хвилі характеристичного рентгенівського випромінювання елемента і кількістю протонів у його атомі. (Г. Мозлі загинув на фронті Першої світової війни, чим і зумовлена його відсутність серед лауреатів Нобелівської премії, яка посмертно не присуджується.) Це відкриття відоме сьогодні під назвою закону Мозлі. Згідно з ним елементи Періодичної системи мають порядковий номер, який відповідає кількості протонів у їхніх атомах. Цим законом було остаточно визначено число і будову всіх природних елементів, а також будову штучно синтезованих. На підставі відкритого закону Г. Мозлі вказав номери ще не відкритих на той час трьох природних елементів: 43 — технецій, 61 — прометій, 75 — реній (рис. 26).
