Сторінка
7
Теплові ефекти можна включати в рівняння реакцій. Хімічні рівняння, у яких зазначено кількість теплоти, що виділяється або поглинається, називаються термохімічними рівняннями. Так, теплота утворення водяної пари дорівнює 241,8 kJ/mol; відповідне термохімічне рівняння має вигляд:
![]() .
.
Зрозуміло, що різниця між теплотою утворення рідкої води (285,8 kJ/mol) і водяної пари (241,8 kJ/mol) є теплотою випаровування води за 25ºС, віднесеною до одного моля.
Теплота утворення оксиду азоту (ІІ) від’ємна і дорівнює –90,25 kJ/mol. Відповідне термохімічне рівняння має вигляд:
![]() або
або ![]() .
.
Розглянемо два основні закони термохімії, які відображають закон збереження енергії і відіграють важливу роль у розрахунках теплових балансів природничих і технологічних процесів.
Перший закон термохімії стверджує, що тепловий ефект прямої реакції дорівнює за абсолютним значенням тепловому ефекту зворотної реакції, але є протилежним за знаком.
Другий закон термохімії (закон Гесса) відповідно до викладених раніше визначень можна сформулювати так:
Тепловий ефект низки послідовних перетворень речовин не залежить від продуктів проміжних стадій, а лише від енергетичного стану вихідних реагентів і кінцевих продуктів.
За законом Гесса сформульовано правило: тепловий ефект реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних реагентів. При цьому слід ураховувати стехіометричні коефіцієнти реакції та знак теплового ефекту і пам’ятати, що теплоту утворення простих речовин узято за нульову.
Наприклад, у реакції відновлення заліза з оксиду (Fe2O3 + 3 CO = = 2 Fe + 3 CO2) тепловий ефект Q становитиме:
![]()
Закон Гесса дає змогу визначити тепловий ефект перетворень кристалічної будови речовини, коли його безпосередньо не можна виміряти, наприклад, за перекристалізації (алотропного перетворення) вуглецю із алмазу в графіт:
![]() .
.
Для визначення Q треба порівняти теплові ефекти реакцій згоряння алмазу і графіту:
![]() ;
;
![]() ;
;
![]() .
.
Якщо середовище отримує енергію (екзотермічна реакція), то тепловий ефект позначаємо знаком «+», і, навпаки, якщо енергія з навколишнього середовища поглинається, то тепловий ефект позначаємо знаком «–». Але в термодинаміці, яку ми будемо розглядати пізніше, тепловий ефект (ентальпія ![]() ) позначається за екзотермічних реакцій знаком «–» (
) позначається за екзотермічних реакцій знаком «–» (![]() ), а за ендотермічних, навпаки, знаком «+» (
), а за ендотермічних, навпаки, знаком «+» (![]() ). Наприклад, ендотермічна реакція водяної пари і коксу може бути виражена двома рівнозначними записами:
). Наприклад, ендотермічна реакція водяної пари і коксу може бути виражена двома рівнозначними записами:
![]() ;
;
![]() .
.
Структурно-логічні схеми й висновки для повторення розділу 1.2.4
І. Класифікація і принципи побудови.
![]()
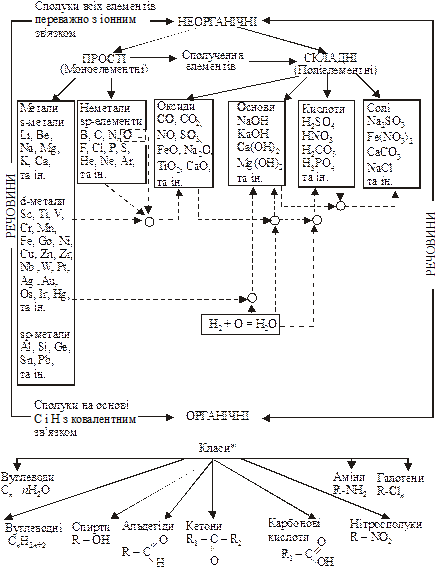 *
*
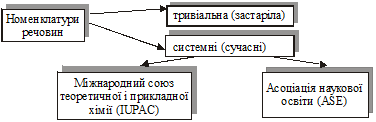
ІІ. Номенклатури речовин (тривіальна і системні).
ІІІ. Побудова назв неорганічних речовин за IUPAC.
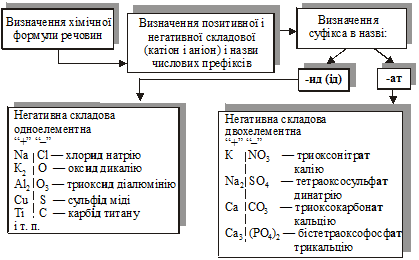
IV. Побудова назв органічних речовин

Загальні висновки до розділу 1.2.4
1. Нині щорічно реєструється близько півмільйона нових хімічних речовин з різними, у тім числі високотоксичними, властивостями. Для їх раціонального і безпечного використання необхідна точна система найменувань, яка б однозначно вказувала на їхній хімічний склад.
2. Класифікацію речовин і розробку системи їхніх назв, тобто номенклатуру, постійно здійснює Міжнародний союз теоретичної і прикладної хімії IUPAC (ІЮПАК).
3. Нині найбільш поширені дві близькі за змістом номенклатури IUPAC і ASE. Останню розроблено Асоціацією наукової освіти. Обидві системи уможливлюють за формулою однозначно назвати речовину, і навпаки — за назвою написати її хімічну формулу.
4. Стехіометрія — основа кількісного визначення речовини в процесах її утворення й розкладу як у живих організмах, так і у виробничих процесах. Стехіометричні методи й розрахунки базуються на законах збереження матерії і енергії.
5. Знання номенклатури речовин і стехіометрії необхідні для розуміння й аналізу як процесів у навколишньому природному середовищі, так і технологічних процесів економіки, а також їхнього взаємовпливу.
