Сторінка
4
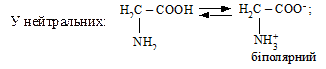
В іонному стані a-амінокислоти можуть утворювати солі типу
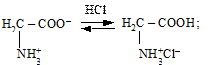
а також брати участь у реакціях заміщення:
![]()
![]()
Ця реакція може тривати далі, формуючи ланцюжки пептидів, 
З поліпептидів складаються молекули білка. Розрізняють три види структури білків: первинну, яка характеризує амінокислотний склад a-амінокислотних залишків у поліпептидному ланцюжку; вторинну — просторову форму ланцюжка; третинну — взаєморозміщення всіх поліпептидних ланцюжків у молекулі білка.
Стехіометрія, її закони і стехіометричні розрахунки
Термін «стехіометрія» ввійшов у науку на початку минулого сторіччя і походить від двох грецьких слів: στοιχειοn — елемент і μετρεω — вимірюю. Сучасний зміст терміна «стехіометрія» можна сформулювати так: наука, що вивчає кількісний (елементний) склад речовин, їхній енергетичний стан та зміни, що відбуваються за їхнього перетворення як у природі, так і в промислових процесах. Базуючись на знаннях природничих законів, системи фізичних величин і номенклатури речовин, стехіометрія відіграє фундаментальну роль у пізнанні глибинних явищ природи і отриманні різноманітних матеріалів для сучасного виробництва. Стехіометричні методи уможливлюють дослідження метаболічних процесів (перетворень речовини та енергії), які відбуваються у живих організмах, і відтак прогнозування змін екологічного характеру, котрі можуть статися під впливом антропогенних факторів на навколишнє середовище. У сучасній економіці виробництво більшості продукції зв’язане з хімічним перетворенням вихідної сировини і без глибокого знання стехіометрії неможлива організація ефективного (з погляду економіки та екології) технологічного процесу. Скільки і якої треба сировини для отримання заданої кількості добрив, полімерів чи пестицидів певного хімічного складу і скільки при цьому утворюється різного складу небажаних токсичних відходів, визначають тільки за допомогою стехіометрії.
Щоб більш переконливо довести непересічне значення стехіометрії для розв’язання сучасних проблем екології (і економіки) досить звернути увагу на той факт, що нині щороку синтезується майже півмільйона нових хімічних сполук — щохвилини нова речовина! З них майже 40 000 потенційно токсичних.
«Ну, а що мені до того?» — скаже дехто з тих, хто вивчає екологію чи економіку. Відповідь тут проста. Ні еколог, ні економіст не буде здатним без необхідних знань зі стехіометрії науково обгрунтувати свої міркування щодо нових економічних проектів, зокрема щодо балансу користі і витрат, які будуть наслідком реалізації проектів.
Пригадуючи основні поняття з хімії середньої школи, не так уже й складно самостійно опрацювати стехіометричні розрахунки еколого-економічного змісту, знаючи, що стехіометрія базується на чотирьох основних природничих законах.
Закон збереження матерії (Лавуазьє, 1774) — це фундаментальний закон природи, згідно з яким матерія не виникає і не зникає за будь-яких перетворень. Саме стехіометричне рівняння відображає цей закон у хімічних реакціях. Загалом можна стверджувати, що кількість і вид атомів, а також і маса речовини (реагенту), що вступає в реакцію, повністю зберігається в продуктах реакції. Саме це дає змогу поставити знак рівняння в матеріальному балансі реакції, де
Маса реагентів = Маса продуктів реакції.
Але, щоб виконати розрахунки, треба знати закони, які визначатимуть склад і кількість продукту залежно від складу реагентів і умов перебігу реакції.
Закон сталості складу, або сталого відношення (Пруст, 1797). Згідно з цим законом кожна хімічна сполука характеризується певним, тільки їй властивим, складом елементів, незалежно від умов і вихідних реагентів, з яких її утворено — природно чи штучно. Отже, співвідношення маси елементів у її складі завжди є незмінною величиною. На підставі цього закону стає можливим точне визначення поняття «речовина».
Проста речовина (хімічний елемент) — це сукупність атомів з однаковим зарядом ядра і однаковою кількістю електронів, але (можливо) з різною атомною масою (різними ізотопами).
Складна речовина — це хімічно стійка сполука сталого складу з будь-яких атомів. Вона характеризується індивідуальними фізико-хімічними властивостями. Фундаментальними поняттями стехіометрії є атомна (молекулярна) маса, кількість речовини, моль, молярний об’єм і деякі інші. Поняття атомна маса (вага) є фізичною величиною, а її одиницю — відносну безрозмірну характеристику — було запроваджено в практику стехіометричних розрахунків задовго до того, як реальність існування атомів було доведено. Не спиняючись тут на цікавій історії визначення атомних мас, нагадаємо лише, що в перших варіантах періодичної таблиці, яка налічувала менше половини відомих нині хімічних елементів (60-ті роки ХІХ ст.), атомну масу найлегшого атома водню було взято за одиницю. Атомні маси всіх інших елементів визначалися як відношення мас кожного з них до маси атома водню. Пізніше за одиницю атомної маси було взято 1/16 маси атома кисню, що виявилося зручнішим для визначення інших атомних мас.
1961 р. було прийнято нову єдину шкалу відносних атомних одиниць мас (або просто атомних мас) — а. о. м., виходячи з 1/12 частини маси атома ізотопу вуглецю ![]() С. Відповідно до цієї шкали а. о. м. водню становить 1,0079, а кисню — 15,9994. Відносна молекулярна маса (скорочено — молекулярна маса) дорівнює сумі атомних мас атомів, що складають молекулу. У хімічних розрахунках широко користуються поняттям «кількість речовини», одиницею якої є моль. Нагадаємо, що фізична величина кількості речовини відображає характеристику будь-якої речовини за кількістю її складових — структурних одиниць (атомів, молекул, іонів, електронів та ін.). Одиниця кількості речовини — моль — це та кількість структурних одиниць, яка дорівнює кількості атомів у 12 грамах вуглецю
С. Відповідно до цієї шкали а. о. м. водню становить 1,0079, а кисню — 15,9994. Відносна молекулярна маса (скорочено — молекулярна маса) дорівнює сумі атомних мас атомів, що складають молекулу. У хімічних розрахунках широко користуються поняттям «кількість речовини», одиницею якої є моль. Нагадаємо, що фізична величина кількості речовини відображає характеристику будь-якої речовини за кількістю її складових — структурних одиниць (атомів, молекул, іонів, електронів та ін.). Одиниця кількості речовини — моль — це та кількість структурних одиниць, яка дорівнює кількості атомів у 12 грамах вуглецю ![]() С. Зрозуміло, що, використовуючи поняття «моль», потрібно в кожному конкретному випадку точно визначити, які структурні одиниці розглядаються, що обумовлює масу молю конкретної речовини.
С. Зрозуміло, що, використовуючи поняття «моль», потрібно в кожному конкретному випадку точно визначити, які структурні одиниці розглядаються, що обумовлює масу молю конкретної речовини.
