Сторінка
1
План
1. Загальна характеристика
Фізичні властивості
Електронна конфігурація та будова атома
2. Історія відкриття
3. Методи отримання та дослідження
4. Хімічні властивості
5. Використання
6. Список використаної літератури
Загальна характеристика
Фізичні властивості:
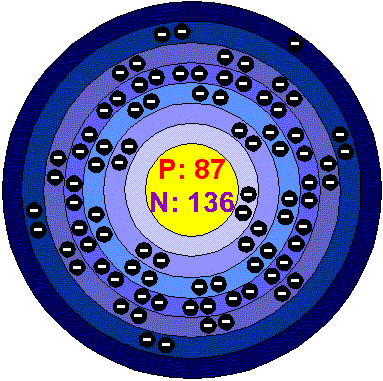
Атомний номер: 87 Атомна маса: 223,0197 Густина: 1870 кг/м3
Температура плавлення: 27.0 °C (300.15 °K, 80.6 °F) Температура кипіння: 677.0 °C (950.15 °K, 1250.6 °F) Кількість протонів/електронів: 87 Кількість нейтронів: 136(ізотоп 87Fr223)Температура плавлення: 18-21°С
Електронна конфігурація та будова атома:
Електронна конфігурація: 1s22s22p63s23p63d104s24p6 4d104f145s25p65d106s26p67s1
Будова атома:
|
|
Кількість енергетичних рівнів: 7 Перший енергетичний рівень: 2 ел. Другий енергетичний рівень: 8 ел. Третій енергетичний рівень: 18 ел.Четвертий енергетичний рівень: 32 ел.П’ятий енергетичний рівень: 18 ел. Шостий енергетичний рівень: 8 ел.Сьомий енергетичний рівень: 1 ел. |
Найбільш стабільні ізотопи:
| Ізотоп | Період напіврозпаду | Вид радіоактивності | Результат розпаду |
| Fr-212 | 20.0 хв | α/β+ | At-208/Rn-212 |
| Fr-221 | 4.8 хв | α/β– | At-217/Ra-221 |
| Fr-222 | 14.3 хв | β– | Ra-222 |
| Fr-223 | 21.8 хв | α/β– | At-219/Ra-223 |
| Fr-225 | 4.0 хв | β– | Ra-225 |
| Fr-210 | 3.18 хв | α/β+ | At-206/Rn-210 |
Історія відкриття
Кажуть, що немає правил без виключень. І якщо вважати правилом той факт, що історія відкриття хімічних елементів зв’язана насамперед із представниками сильної половини людства, то приємним виключенням будуть три жіночих імені, якими вправі пишатися слабка стать: Марія Склодовська-Кюрі – першовідкривач полонію і радію, Іда Ноддак (Такке), що відкрила реній, і Маргарет Пере, якій судилося відкрити франций. Анітрохи не применшуючи величезних заслуг Марії Склодовської-Кюрі та Іди Ноддак, відмітимо, що науковий успіх вони поділяли зі своїми чоловіками П’єром Кюрі і Вальтером Ноддаком, у той час як Маргарет Пере при «народженні» францію обійшлася «без сторонньої допомоги».
Відкриття елементу № 87 (а саме під цим номером значиться францій у таблиці елементів) хіміки усього світу чекали довго – практично сім десятиліть. Справа в тім, що Д. І. Менделєєв, споруджуючи стрункий будівлю своєї періодичної системи, не завжди мав «під рукою» підходящий «будівельний» матеріал, і тому багато клітинок таблиці залишилися порожніми. Але геніальний учений розумів, що ці порожнечі – справа тимчасова: відповідні їм «цеглинки» повинні існувати в природі, але поки їм вдається залишатися непоміченими. Менделєєв не тільки вказав майбутнє «місце проживання» ряду елементів, але і з великою точністю передбачив фізичні й хімічні властивості цих незнайомців.
Життя незабаром підтвердило блискучий прогноз ученого: у 1875 році були відкриті галій (Менделєєв називав його ека-алюмінієм, справедливо вважаючи, що по властивостях він буде схожий на свого сусіда зверху по таблиці елементів), у 1879 році – скандій (ека-бор), а в 1886 році – германій (ека-силіцій).
У статті «Природна система елементів і застосування її до вказівки властивостей невідкритих елементів», опублікованої в 1871 році, Менделєєв писав: «Потім у десятому ряді можна чекати ще основних елементів, що належать до I, II і III груп. Перший з них повинний утворювати оксид R2O, другий – RO, а третій – R2O3; перший буде подібний із цезієм, другий – з барієм, а всі їхні оксиди повинні володіти, звичайно, характером найенергійніших основ».