Сторінка
6
Оксиди вуглецю
Оксид вуглецю (II), чи чадний газ.
Оксид вуглецю (II) - це безбарвний отруйний газ, без запаху, погано розчинний у воді . Оксид вуглецю (II) - отрутний газ. Легке отруєння викликає слабість, головний біль, нудоту, блювоту. Це пояснюється тим, що СО, потрапивши в кров, з'єднується з гемоглобіном, у результаті чого останній втрачає здатність приєднувати кисень. Це і приводить до ядухи. СО- оксид несолетвірний.
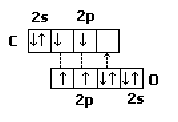 Молекули CО дуже міцні, оскільки зв'язок між атомами вуглецю і кисню в них потрійний. Механізм утворення такого зв'язку можна зобразити так:
Молекули CО дуже міцні, оскільки зв'язок між атомами вуглецю і кисню в них потрійний. Механізм утворення такого зв'язку можна зобразити так:
.
Два зв'язки в молекулі СО виникають за рахунок двох неспарених електронів у атомів вуглецю і кисню. Третій зв'язок утворюється за донорно-акцепторним механізмом за рахунок неподіленої пари електронів на р-орбіталі вуглецю (акцептор):
![]()
.
Але тому що в оксиді вуглецю ступінь окиснювання вуглецю +2, а найбільш стійкою сполукою вуглецю є оксид вуглецю (IV) зі ступенем окиснювання вуглецю +4, то для оксиду вуглецю повинні бути характерні відновні властивості, тобто реакції приєднання кисню. Це властивість оксиду вуглецю використовується при відновленні металів з оксидів:
![]() .
.
На повітрі оксид вуглецю горить блакитнуватим полум'ям з виділенням великої кількості тепла, що дозволяє використовувати його як газоподібне паливо (генераторний газ):
![]() кДж/моль.
кДж/моль.
У лабораторії СО можна одержати, відокремлюючи воду сірчаною кислотою від мурашиної кислоти (реакція йде при нагріванні):
У техніці оксид вуглецю одержують у так званих газогенераторах. Газогенератор - це колоноподібна піч, яку заповнюють твердим паливом (коксом, вугіллям, деревиною) і знизу продувають повітря. Вуглець, що згоряє у нижніх шарах, утворює СО2, при цьому виділяється велика кількість тепла, за рахунок чого верхні шари палива розжарюються до високої температури. Оскільки кисень повітря витрачається у нижніх шарах на утворення СО2, верхні шари палива окиснюватися не можуть. У цих умовах СО2 , який надходить з нижніх шарів, взаємодіє з вуглецем з утворенням СО:
![]() Дж/моль (кг).
Дж/моль (кг).
На базі оксиду вуглецю оснований ряд синтезів. Наприклад, одержання метилового спирту:
![]()
одержання рідкого палива взаємодією оксиду вуглецю з воднем:
Нещодавно розроблено спосіб одержання альдегідів і спиртів взаємодією оксиду вуглецю і водню з неграничними вуглеводнями:
![]()
Процес ведуть під тиском у присутності каталізаторів. Більш детально синтез СО-водень буде розглянутий далі.
Оксид вуглецю (IV), чи вуглекислий газ.
Молекула вуглекислого газу СО2 має лінійну будову: О==С==О.
Схему перекривання атомних орбіталей у молекулі СО2 можна представити у такий спосіб. Як видно з графічної формули СО2, вуглець утворює два σ- і два π-зв'язки з атомами кисню. Будова зовнішнього електронного шару чотиривалентного атома вуглецю :
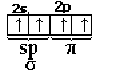
.
p-зв'язки, як відомо, можуть утворюватися тільки за рахунок перекривання пелюсток р-орбіталей. Отже, σ-зв'язки атом вуглецю буде утворювати за рахунок перекривання двох своїх sp-гібридних орбіталей з р-орбіталями атомів кисню.
Спрощено схему σ- і π-зв'язків у молекулі СО2 можна представити так:
.
У невеликих кількостях (0,03 % за об'ємом) вуглекислий газ завжди є у повітрі. Він не має кольору та запаху. При 194,5 К перетворюється у тверду сніжноподібну масу, так званий "сухий лід", який сублімірується, не плавлячись.
У одиниці об'єму води при 20 °С розчиняється відносна одиниця об'єму СО2, зі збільшенням тиску розчинність зростає.
Вуглекислий газ має усі властивості кислотних оксидів. Однак унаслідок того, що відповідний йому гідроксид - вугільна кислота дуже нестійка, при розчиненні у воді СО2 практично з нею не взаємодіє. Внаслідок того що в СО2 вуглець має ступінь окиснювання +4, то горіти чи підтримувати горіння він не може. Для нього не характерні ні окисні, ні відновні властивості, хоча деякі активні метали можуть горіти в атмосфері СО2, забираючи в нього кисень:
![]()
Одержують вуглекислий газ термічним розкладанням солей вугільної кислоти
![]()
чи дією на них кислотами:
![]() ,
,
а також спалюванням горючих копалин:
![]() .
.
ЛІТЕРАТУРA
1. Саранчук В.И., Айруни А.Т., Ковалев К.Е. Надмолекулярная организация, структура и свойства углей.- К.: Наукова думка.
2. Саранчук В.И., Бутузова Л.Ф., Минкова В.Н. Термохимическая деструкция бурых углей.- К.: Наукова думка, 1984.
3. Нестеренко Л.Л., Бирюков Ю.В., Лебедев В.А. Основы химии и физики горючих ископаемых.- К.: Вища шк., 1987.-359с.
4. Бухаркина Т.В., Дигуров Н.Г. Химия природных энергоносителей и углеродных материалов.-Москва, РХТУ им. Д.И. Менделеева,-1999.-195с.
5. Агроскин А. А., Глейбман В. Б. Теплофизика твердого топлива.-- М. Недра 1980.-- 256 с.
6. Глущенко И. М. Теоретические основы технологии твердых горючих ископаемых.-- К. : Вища шк. Головное изд-во, 1980.-- 255 с.
