Сторінка
4
Завдяки властивостям цієї структури їй пророкують широке растосування у майбутньому в мікроелектроніці, оптиці, мікрохвильовій і електричній технології, конструкції джерел струму і медицині. В усіх цих областях ключове значення має висока стабільність фізичних і хімічних властивостей. У зв'язку з цим викликає інтерес зміна поверхні карбіна в атмосфері повітря протягом декількох років, що пройшли після синтезу, а також його модифікація в умовах надвисокого вакууму. Електропровідність карбіну помітно зростає при освітленні. На цьому засновані перші практичні кроки по використанню нового матеріалу у техніці. Карбінові фотоелементи надійні аж до 500 °С, перевершуючи інші подібні прилади.
В карбіні спостерігається лінійне розташування атомів, у виді ланцюжків. Він підрозділяється на дві модифікацій: з кумульованими зв'язками =С=С=С= (β-карбін) і поліїновими зв'язками ![]() (α-карбін).
(α-карбін).
Ці модифікації розрізняються за сполукою продуктів озонування
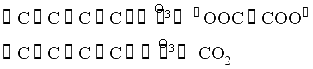 .
.
Історія хімії знає чимало прикладів, коли яку-небудь речовину, отриману в лабораторії, знаходили потім у природі. Так сталося і з карбіном. У журналі "Science" було опубліковане повідомлення, що в кратері Ріс, розташованому недалеко від Мюнхена, науковці знайшли мінерал, який складається практично з чистого вуглецю. До загального подиву його структура нітрохи не нагадувала ні алмаз, ні графіт. А от з карбіном у нього багато загального, і насамперед -- однакова структура елементарної комірки. Правда, параметри граней ґрати різні, але величини їх кратні. Крім того, речовина з кратера Ріс сірого кольору. Такі розбіжності легко пояснюються хоча б з того погляду, що порівнювані сполуки -- полімери, властивості яких значною мірою залежать від ступеня полімеризації. До того ж якщо це не алмаз і не графіт то йому нічим бути, крім як природним карбіном.
Так воно і виявилося. Дифракція рентгенівських променів у вуглеці, знайденому в Баварії, і у вуглеці, синтезованому в лабораторії, практично однакова. До речі, зовсім недавно російські вчені з графіту за допомогою лазерного променя ідентифікували мікрокристали білого карбіна. Науковці спробували було перетворити карбін в алмаз по перевіреній на графіті схемі, але марне. Утім, так воно повинно і бути. Адже теоретичні розрахунки саме і говорять про найбільшу термодинамічну стійкість нової форми елементарного вуглецю. Крім того, очікується, що нитковидні кристали карбіна виявляться найбільш міцними матеріалами на Землі.
Фулерени
Історія відкриття фулерена, можливо, сама незвичайна. В 1973 р. російські вчені Д.А. Бочвар і Е.Н. Гальперн опублікували результати квантово-хімічних розрахунків, з яких випливало, що повинна існувати стійка форма вуглецю, що містить у молекулі 60 вуглецевих атомів і не має ніяких замінників. В тій же статті була запропонована форма такої гіпотетичної молекули. Висновки цієї роботи здавалися в той час зовсім фантастичними. Ніхто не міг собі уявити, що така молекула може існувати, і тим більше -- як узятися за її одержання. Ця теоретична робота трохи випередила свій час і була спочатку просто забута.
У 1980-х рр. астрофізичні дослідження дозволили встановити, що в спектрах деяких зірок, так званих "червоних гігантах", виявлені смуги, що вказують на існування чисто вуглецевих молекул різного розміру.
У 1985 р. Г.Крото і Р.Смоллі почали проводити дослідження вже в "земних" умовах. Вони вивчали мас-спектри парів графіту, отриманих під ударом лазерного променя, і знайшли, що в спектрах є два сигнали, інтенсивність яких набагато вище, ніж всіх інших. Сигнали відповідали масам 720 і 840, що вказувало на існування великих агрегатів з вуглецевих атомів -- С60 і С70. Мас-спектри дозволяють установити лише молекулярну масу частинки і не більш того, однак цього виявилося досить, щоб фантазія вчених запрацювала. У підсумку була запропонована структура багатогранника, зібраного з п'яти - і шестикутників. Це було точне повторення структури, запропонованої 12 років тому Бочваром і Галперном.
Назву "фулерен" було дано на честь відомого американського архітектора Бакмінстера Фуллера, що запропонував будувати ажурні куполоподібні конструкції сполученням п'яти - і шестикутників. На перший погляд здається, що конструкція зібрана з трикутників, однак чергування п'яти - і шестипроменевих центрів саме і відповідає будові фулерена. Якийсь час фулерен був доступний лише в кількостях, достатніх для спектральних досліджень, але не хімічних. Одержати фулерен у помітних кількостях вдалося Д.Хаффману і В.Кретчмеру, що провели випарювання графіту за допомогою електричної дуги в атмосфері гелію. Сажа, що утворюється в цьому процесі, була проекстрагована бензолом. З розчину виділили сполуки, що мають суміш С60 і С70; друга сполука утворюється в кількостях, приблизно в шість разів менших, ніж перша, і тому основна маса досліджень проводиться з С60. Описаний спосіб одержання фулерена з тими чи іншими технологічними варіаціями на сьогодні усе ще єдиний. Вміст фулеренів у сажі, що утворюється, досягає 44 %. Існують схеми синтезу фулерена способами органічної хімії, але вони поки не реалізовані. У каталогах хімічних реактивів речовина С60 має назву бакмінстерфулерен, хіміки частіше називають його просто фулереном. Є й інша образна назва -- футболен. Подібність з покришкою футбольного м'яча очевидна. Існує ще гібрид обох назв -- бакібол. Відкриття фулерена буквально приголомшило хіміків. Здавалося, що про елементарний вуглець відомо практично усе. Від інших алотропних модифікацій вуглецю фулерен -- відрізняється насамперед тим, що це індивідуальні кінцеві молекули, що мають замкнуту форму. Фулерен на відміну від відомих раніше трьох форм вуглецю розчинний в органічних розчинниках (бензол, гексан, сірковуглець). З розчинів фулерен кристалізується у виді дрібних темно-коричневих кристалів. Для рентгеноструктурного аналізу вони не придатні, тому що через сферичну форму молекул їхня структура розупорядкована. Побачити молекулу фулерена "своїми очима" вдалося далеко не відразу, лише після того, як був отриманий продукт взаємодії фулерена з тетроксидом осмію Os4 у присутності трет-бутилпіридину, який добре кристалізується.
