Сторінка
2
Кристалічні ґратки алмаза складаються з атомів вуглецю, з'єднаних між собою дуже міцними ковалентними σ-зв'язками, що утворені за рахунок перекривання sp3-гібридних орбіталей атомів вуглецю і розташовані, отже, під тетраедричними кутами.
Звичайно алмази безбарвні, але бувають синього, блакитного, червоного кольору. Алмаз -- найбільш тверда з усіх відомих у природі речовин. Грановані прозорі алмази називають діамантами. Однак, на виготовлення ювелірних виробів йде незначна кількість алмазів (15 %). Основна частина їх використовується в техніці: алмазний пил -- для шліфування твердих матеріалів, тонкого заточення токарських різців; алмазні стовпчики в бурильній справі.
На території колишнього Радянського Союзу родовища алмазів було знайдено в Якутії, на Середньому Уралі, в Архангельській області РФ, і в Донецькій області України.
Кристали алмаза мають октаедричну форму, кожен атом кристалічних ґраток розташований у центрі тетраедра з інших атомів вуглецю. Усі відстані між атомами однакові (0,15445 нм), як і кути між зв'язками (109,5 °). Кристали алмаза безбарвні, відрізняються високим показником заломлення і твердістю (рис. 1.3).
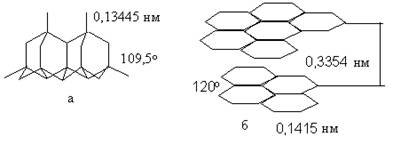
Рис. 1.3 Структура кристалів алмаза (а) і графіту (б)
Графіт
Графіт являє собою темно-сіру з металевим блиском, м'яку, жирну на дотик речовину, густина його 2,17-2,3 г/см3. Добре проводить струм, на повітрі не замається навіть при сильному розжарюванні, а в кисні горить, утворюючи CO2.
Як і в алмазі, у графіті кожен атом вуглецю утворює один з одним чотири зв'язки. Однак ці зв'язки не однакові. Три з них є σ-зв'язками, утвореними в результаті перекривання sp2-гібридних орбіталей атомів вуглецю. Усі вони розташовуються в одній площині під кутом 120°, утворюючи безперервну плоску сітку, що складається з правильних шестикутників, у кутах яких знаходяться атоми вуглецю. Четвертий p-зв'язок утворюється за рахунок перекривання пелюстків p-орбіталей вище і нижче площини, у якій розташовані атоми вуглецю. p-зв'язок утворює суцільну електронну хмару по всьому шару атомів вуглецю, як і у випадку металевого зв'язку. Вуглецеві шари у графіті зв'язані дуже слабкими силами міжмолекулярної взаємодії. Ці особливості будівлі графіту й обумовлюють такі його властивості, як електропровідність, шаруватість і т.д.
Графіт використовується для виготовлення олівців, тугоплавких тиглів, електродів, мастильних матеріалів, як сповільнювач у ядерних реакторах.
На території країн СНД родовища графіту знайдено в Східному Сибіру, на Алтаї й в Україні.
Сьогодні графіт одержують штучним шляхом -- прожарюванням суміші піску і подрібненого антрациту чи коксу в електричних печах. Штучний графіт відрізняється винятковою чистотою і м'якістю, тому цінується вище природного.
Графіт, якщо розглядати його ідеалізовану структуру, являє собою безперервний ряд шарів, рівнобіжних основній площині, що складаються з гексагонально зв'язаних один з одним атомів вуглецю (мал.1.2). За взаємним зсувом цих шарів у площині розрізняють гексагональну і ромбоедричну форми. У гексагональній формі шари чергуються за схемою А-В-А-В- ., а в ромбоедричній -- за схемою А-В-С-А-В-С- . Зміщення шарів у ромбоедричній формі може досягати в природних графітах 30 %, у штучних вона практично не зустрічається. Відстань між будь-якими сусідніми атомами вуглецю в площині шару дорівнює 0,1415 нм, між сусідніми шарами 0,3354.
Така будова приводить до анізотропії фізичних властивостей графіту в напрямках рівнобіжному і перпендикулярному злому.
Описана структура характерна для монокристала графіту. Реальні тіла складаються з безлічі областей упорядкованості вуглецевих атомів, що мають кінцеві розміри, які відрізняються на кілька порядків для різних зразків вуглецевих тіл графітової чи графітоподібної структури. Структура цих областей може наближатися до ідеальних ґраток графіту чи відрізнятися від неї за рахунок перекручувань усередині шарів, так і за рахунок неправильностей їхнього чергування. Такі області упорядкованості називаються кристалітами і мають власні геометричні характеристики: La - середній діаметр, Lc - середня висота кристаліта і d002 - середня відстань між зломами у кристаліті. Ці величини визначаються за допомогою рентгенографічного аналізу. Крім того, у реальних графітових тілах є деяка кількість неупорядкованих атомів (аморфний вуглець), що займають простір між кристалітами чи впроваджені між шарами. Ці атоми можуть, знаходиться в sp, sp2 чи sp3- гібридному стані.
Графіт і алмаз можуть за певних умов переходити один в одного. Інформацію про термодинамічні параметри, при яких стабільні кристалічні модифікації вуглецю, дає діаграма стану вуглецю. При її складанні були досліджені умови рівноваги між різними фазами, зокрема були обчислені рівноважні температури і тиски для системи "графіт-алмаз":
|
Т,К |
0 |
298 |
400 |
500 |
600 |
700 |
800 |
900 |
1000 |
1100 |
|
р,ГПа |
1,35 |
1,61 |
1,82 |
2,05 |
2,30 |
2,60 |
2,85 |
3,15 |
3,40 |
3,70 |
При температурах вище 1200 К крива рівноваги може бути представлена виразом:
р = 0,7 + 0,0027Т.
При атмосферному тиску і високих температурах графіт сублімує, не переходячи в рідкий стан, але при високих тисках і температурах він плавиться, що було встановлено по стрибку електроопору, приблизно при Т=4000 К і р=10 МПа. Точка рівноваги графіт-алмаз-розплав знаходиться в області Т=4000-4200 К и р=12,5-13,5 ГПа.
В області тисків, близьких до атмосферного, фаза алмазу термодинамічно менш стійка, ніж фаза графіту. Однак, існує можливість одержувати алмаз в умовах його термодинамічної нестабільності, синтезуючи алмаз з газової фази. Цей процес йде відповідно до правила ступеней Оствальда, коли можливий ряд перетворень від нестійкого стану (вуглець газової фази) до найбільш стійкого (графіт) через проміжні (зокрема алмаз). На одній з цих ступеней процес може бути зупинений. Для спрямування його у бік алмазу діють наступним чином. Проводять піроліз вуглецевого газу (ацетилен, метан та ін.) у реакційній посудині з підкладкою - кристалів алмазу. На гранях такого кристала надлишок атомів вуглецю з газової фази виділяється у тверду, "орієнтуючись" на вже наявні кристалічні ґратки.
