Сторінка
3
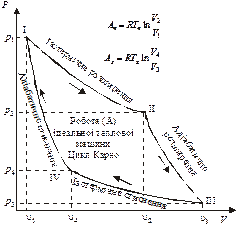
Ми не будемо тут наводити опис дослідів з «ідеальною тепловою машиною», яка забирає теплоту від нагрівача і віддає холодильнику, дослідів, які дали змогу визначити знаменитий «Цикл Карно» (рис. 16). Наведемо лише (для допитливих) кілька загальних розрахунків роботи такої ідеальної теплової машини (розрахунок роботи ізотермічного процесу вже наводився).
|
Рис. 16. Цикл Карно ідеальної теплової машини |
На першому відрізку циклу (І—ІІ) ідеальний газ за незмінної початкової температури ![]() підігрівача, від якого надходить тепло, виконує роботу А ізотермічного розширення:
підігрівача, від якого надходить тепло, виконує роботу А ізотермічного розширення:
![]() .
.
Робота на цій ділянці виконується тільки за рахунок тепла, яке надходить до системи, оскільки за ![]() —
— ![]() внутрішня енергія газу також не змінюється. Отже, можна записати:
внутрішня енергія газу також не змінюється. Отже, можна записати: ![]() .
.
На другому відрізку циклу (ІІ—ІІІ) система продовжує виконувати роботу без надходження тепла в адіабатичному процесі розширення за рахунок зменшення внутрішньої енергії ![]() .
.
Наступний процес циклу (ІІІ—ІV) — ізотермічне стискання газу відбувається за сталої температури холодильника ![]() за рахунок витрати зовнішньої роботи (над системою):
за рахунок витрати зовнішньої роботи (над системою): ![]() . При цьому тепло, в яке трансформується робота стискання газу системи
. При цьому тепло, в яке трансформується робота стискання газу системи ![]() , цілком переходить до холодильника (внутрішня енергія системи не змінюється). Отже,
, цілком переходить до холодильника (внутрішня енергія системи не змінюється). Отже, ![]() .
.
На останньому відрізку циклу (ІV—I) для стискання газу необхідно, як і на попередньому, витратити зовнішню роботу над системою, але за адіабатичного процесу, в якому енергія роботи повністю витрачається на підвищення внутрішньої енергії температури системи. Відрізок (IV—І) завершує цикл за температури нагрівача ![]() , і система повертається до початкового стану.
, і система повертається до початкового стану.
Аналізуючи наведені вище розрахунки Аn і Аx та графік циклу Карно (рис. 16), зауважимо, що площа, обмежена V1 – I – II – III – V3, відображає повну роботу системи ідеального газу (Sсист.) за збільшення її об’єму від V1 до V3, а площа, обмежена V1 – I – II – III – V3, — роботу зовнішньої сили над системою — Sнадсист., зменшуючи її об’єм від V3 до V1. Це повертає систему до вихідного стану. При цьому завжди Sсист. > Sнадсист
Отже, висновок: така теплова машина може працювати безперервно, перетворюючи за кожного циклу лише частину теплової енергії, отриманої від нагрівача, в роботу, що дорівнює різниці площі Sсист. і Sнадсист., тобто площі, обмеженої графіком циклу Карно (I – II – III – IV – І).
Отже, ідеальна машина перетворила в роботу тільки частину тепла — «високотемпературну енергію» (за ![]() ), яку отримала від підігрівача
), яку отримала від підігрівача ![]() , а другу частину —
, а другу частину — ![]() — «транзитом» уже як «низькотемпературну» (за
— «транзитом» уже як «низькотемпературну» (за ![]() ) передала холодильнику. Запишемо їх співвідношення:
) передала холодильнику. Запишемо їх співвідношення: ![]() , або
, або ![]() , або
, або ![]() .
.
Величина h і є відомим коефіцієнтом корисної енергії (корисної дії) як штучної машини, так і природних процесів, наприклад океанічних течій від теплих широт до полярних. Як бачимо, ![]() завжди менше за одиницю. Саме це і є одним із положень другого закону термодинаміки.
завжди менше за одиницю. Саме це і є одним із положень другого закону термодинаміки.
Ілюстрацією дії другого закону термодинаміки в природному процесі може бути явище, яке вже було розглянуто за визначення ентальпії фотосинтезу: коефіцієнт конверсії сонячної енергії, яка надходить до зеленого листка з температурою, близькою до температури виходу, становить лише 0,02…0,04.
У техніці за рахунок більшої різниці температур робочої речовини «на вході» і «на виході», наприклад у двигунах внутрішнього згоряння чи турбінах, коефіцієнт конверсії (корисної дії) на порядок вищий.
Зі сказаного можна зробити два важливі висновки:
1) усі довільні процеси як в природі, так і в техніці, котрі зв’язані з перетворенням енергії, можуть відбуватись тільки за умов зниження її концентрованості, своєрідного розсіювання, як це має місце, коли тепло «енергії високої температури» гарячого предмета довільно «перетікає» в холодний предмет і, нагріваючи його, розсіюється в ньому, перетворюючись на «енергію нижчої температури»;
2) що нижча концентрованість енергії, то менша ефективність її перетворення (нижчий ![]() ) у впорядковану форму енергії — роботу чи внутрішню енергію хімічної структури речовини. У процесах перетворення тепла на роботу коефіцієнт конверсії (
) у впорядковану форму енергії — роботу чи внутрішню енергію хімічної структури речовини. У процесах перетворення тепла на роботу коефіцієнт конверсії (![]() ) збільшується, коли більшою є різниця температур між теплом «на вході» і «на виході» робочої речовини.
) збільшується, коли більшою є різниця температур між теплом «на вході» і «на виході» робочої речовини.
За другим законом термодинаміки саме міра концентрованості енергії чи структурної впорядкованості системи в цілому визначається спеціальною функцією стану системи — ентропією (від грец. — перетворення). Ентропія позначається великою латинською літерою S. Як і відомі нам функції стану системи: тиск (P), об’єм (V), температура (T), внутрішня енергія (U) і ентальпія (H), нова функція — ентропія характеризує стан системи і її зміни.
Якщо перший закон термодинаміки називають законом збереження енергії, то другий — законом зміни ентропії.
Теорія термодинаміки показує, що зміна ентропії ![]() системи дорівнює відношенню енергії, яка передається (ізотермічно) у формі теплоти q, до абсолютної температури T, що можна записати рівнянням:
системи дорівнює відношенню енергії, яка передається (ізотермічно) у формі теплоти q, до абсолютної температури T, що можна записати рівнянням: