Сторінка
2
Иодид цинку Zn2. Безбарвні гексагональні кристали. Кристалічні ґрати типу Cd2. tпл=446°С, tкип=624°С [1], щільність дорівнює 4,92 г/см3 [2]. Розчиняється у воді, спирті, ефірі і кислотах. Відомі кристаллогидрати Zn2.4Н2O, Zn2.2Н2O. Молярна електропровідність при нескінченному розведенні при 25ос дорівнює 261,6 Див.див2/моль [4]. Одержують безпосереднім синтезом з елементів.
Сульфід цинку Zn. У природі зустрічається у виді мінералу чи сфалериту вюртцита. Біла аморфна речовина. tпл=1900°С, tкип=1185°С. Мало розчинний у воді, лугах, і оцтовій кислоті. Добре розчиняється в мінеральних кислотах з виділенням сірководню. Одержують дією сірки на цинк, чи оксид карбонат цинку, обробкою розчинів солей цинку сульфідом амонію. Застосовується для виготовлення екранів, чуттєвих до дії рентгенівських променів і радіоактивного випромінювання.
|
|
-205,4 кдж/моль; |
|
-200,7 кдж/моль; |
|
57,7 Дж/моль.K [3]. |
Сульфат цинку ZnSO4. Безбарвні орторомбические кристали з щільністю 1,97 г/см3 [2]. Розкладається при 770ос. Відновлюється чи вугіллям сіркою до сульфіду. Легко розчиняється у воді, мало розчинний у спирті. Існують кристаллогидрати ZnSO4.n2O (n=6, 4, 2, 1). Молярна електропровідність при нескінченному розведенні при 25ос дорівнює 268 Див.див2/моль [4]. Одержують взаємодією цинку, оксиду, гидроксида чи карбонату цинку із сірчаною кислотою. Застосовується для одержання сполук цинку, для просочення деревини й у фармацевтичній промисловості.
|
|
-981,4 кдж/моль; |
|
-870,12 кдж/моль; |
|
110,54 Дж/моль.K [3]. |
Нітрат цинку Zn(NO3)2. Безбарвні тетрагональні кристали. tпл=36°С, щільність дорівнює 2,130 г/см3 [2]. Розчиняється у воді і спирті. Відомі кристаллогидрати Zn(NO3)2.nН2O (n=9, 4, 2, 1). Молярна електропровідність при нескінченному розведенні при 25ос дорівнює 250,92 Див.див2/моль [4]. Одержують взаємодією оксиду, гидроксида, чи карбонату цинку з азотною кислотою.
Ортофосфат цинку Zn3(PO4)2. Безбарвні ромбічні кристали, tпл=1060°С, tпл=900°С [2], щільність дорівнює 4,0 г/см3 [2]. Мало розчинний у воді і спирті. Відомий кристаллогидрат Zn3(PO4)2.4H2O. Молярна електропровідність при нескінченному розведенні при 25ос дорівнює 738 Див.див2/моль [4]. Одержують взаємодією хлориду цинку з гидроортофосфатом натрію.
Карбонат цинку ZnCO3. У природі зустрічається у виді мінералу смітсоніту. Безбарвні тригональні кристали з щільністю 4,44 г/см3 [2]. Мало розчинний у воді, розчиняється в кислотах і лугах. При 300ос розкладається, перетворюючи в оксид цинку. Молярна електропровідність при нескінченному розведенні при 25ос дорівнює 246,6 Див.див2/моль [4]. Одержують обробкою розчинів солей цинку розчином гідрокарбонату чи калію пропущенням вуглекислого газу через суспензію гидроксида цинку.
|
|
-812,53 кдж/моль; |
|
-730,66 кдж/моль; |
|
80,33 Дж/моль.K [3]. |
Одним з найпростіших представників двухосновних карбонових кислот є про-фталева кислота (H2Pht). Раніше нами показана розмаїтість способів координації H2Pht чи її залишків HPht-, Pth-2 у комплексах Cu(II). У залежності від стехіометрії й умов синтезу може менятся як структурна функція лиганда, так і спосіб приєднання кожної з карбоксильних груп. Синтезовано два ряди комплексів двовалентного цинку з про-фталевою кислотою загальною формулою Zn(Pht)A2 (I-III) і Zn(Pht)A (IV), де А-ароматичний амін. Методом рентгеноструктурного аналізу (КUMA-CCD, Moa - випромінювання, прямі методи, анізотропне МНК) визначена будівля сполук I (A = Py), II (A = b -Pic), III (A = g -Pic) і IV (A = g -Pic). В обох випадках реалізовані цепочечние структури з мостиковой функцією Pth. На мал. представлена будівля I і IV.

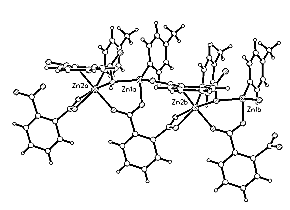
У сполуках I-III Pth виступає як бидентатний лиганд, приєднаний до сусідніх атомів Zn через різні карбоксильние групи. Координація двох незалежних атомів цинку - тетраедрическая. У IV структурна функція карбоксильних груп для двох незалежних залишків Pth істотно складніше - вони виконують роль одноатомних містків Zn-O-Zn, хелатов з утворенням чотиричленного циклу, хелатов із приєднанням атомів Про карбоксильних груп в орто-положении до одного атома цинку (Рис.). Кординация двох незалежних атомів цинку в IV різна - октаедрическая і тетраедрическая.
