Сторінка
2
Питання про сталість складу речовин стало предметом семирічної полеміки між Ж. Прустом і К. Бертолле. Унаслідок ретельної експериментальної перевірки погляди Ж. Пруста на той час взяли гору. Висловлене ним положення у 1808 р. було визнане як закон сталості складу.
Насправді ж справедливі погляди обох учених. Це довів російський хімік академік М. С. Курнаков, який на початку XX ст. сформулював уявлення про речовини сталого складу — Дальтоніди і змінного складу — бертоліди.
Отже, закон сталості складу не є справедливим для всіх речовин. Свого часу він відіграв важливу роль, сприяв укріпленню атомно-молекулярного вчення в хімії, оскільки дав змогу розглядати хімічну сполуку як речовину, що складається з певних молекул і тому має сталий склад. У той час (до початку ХХ ст.) вважали, що всі речовини складаються з молекул.
Нині висловлене Ж. Прустом положення законом не вважають. Зараз відомо, що багато речовин мають немолекулярну будову, їхній склад змінюється у певних межах залежно від умов добування. Крім того, навіть деякі речовини молекулярної будови, наприклад полімери, не мають сталого складу.
Закон об'ємних відношень. Відомо, що маса речовин під час хімічних реакцій зберігається незмінною. На відміну від маси об'єм реагентів може суттєво змінюватись. Це відбувається тоді, коли в реакції беруть участь газоподібні речовини або утворюються газоподібні продукти реакції.
Вимірюючи об'єми газів, що вступають у реакцію та утворюються внаслідок неї, французький учений Ж. Гей-Люссак у 1808 р. сформулював закон об'ємних відношень, відомий як «хімічний» закон Гей-Люссака:
Об'єми газів, що вступають у реакцію, відносяться один до одного і до об'ємів добутих газоподібних продуктів як невеликі цілі числа.
При цьому вважається, що всі об'єми газів зведено до однакових температури і тиску. Наприклад, під час синтезу хлороводню з водню і хлору
Н2(г) + Сl2(г) = 2НСl(г)
співвідношення об'ємів газів таке:
V(Н2) : V(С12): V(НС1) =1:1:2,
тобто 1 л водню сполучається з 1 л хлору, утворюючи 2 л хлороводню. Отже, у рівняннях хімічних реакцій коефіцієнти перед 11 формулами газоподібних речовин відповідають їхнім об'ємам.
Закон Авогадро. Виявлену Ж. Гей-Люссаком закономірність пояснює закон, відкритий у 1811 р. італійським ученим Амедео Авогадро.
В однакових об'ємах різних газів за однакових умов (температури та тиску) міститься однакова кількість молекул.
Із закону Авогадро випливають два важливі наслідки.
Перший наслідок:
Один моль будь-якого газу за однакових умов займає однаковий об'єм.
За нормальних умов (н. у.) (тиск в 1 атм (101325 Па) і температура 273,15 К або 0 °С) об'єм 1 моль будь-якого газу дорівнює 22,4 л. Стала Ут - 22,4 л/моль називається молярним об'ємом газу за нормальних умов.
За будь-яких умов
Молярний об'єм газу — це величина, що дорівнює відношенню об'єму газу за даних умов до кількості речовини цього газу
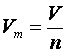
де Vm — молярний об'єм газу, м3/моль (л/моль); V— об'єм газу за даних (будь-яких) умов, м3 (л); n — кількість речовини газу, моль.
За стандартних умов (тиск 1 атм (101325 Па) і температури 298,15 К або 25 °С) молярний об'єм газу дорівнює не 22,4, а 24,4 л/моль.
Молярний об'єм газу Vm можна обчислити також, знаючи молярну масу газу М та його густину.
Молярний об'єм газу — це величина, що дорівнює відношенню молярної маси газу до його густини
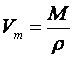
де Vm — молярний об'єм газу, м3/моль (л/моль); М— молярна маса газу, кг/моль (г/моль); р — густина газу, кг/м (г/л).
Другий наслідок: маса одного і того самого об'єму газу тим більша, чим більша маса його молекул. Якщо в однакових об'ємах газів за однакових умов міститься однакова кількість молекул, то, очевидно, що
відношення мас однакових об'ємів газів за однакових умов дорівнює відношенню їхніх молярних мас
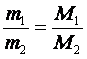
де m1 — маса певного об'єму першого газу; m2 — маса такого самого об'єму другого газу; М1 і М2 — молярні маси відповідно першого і другого газів.
Відношення маси певного об'єму одного газу до маси такого самого об'єму іншого газу (взятого за тих самих умов) називається відносною густиною першого газу за другим.
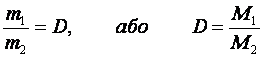
Отже, можна твердити, що густини різних газів, узятих за однакових умов, пропорційні їхнім молярним масам
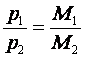
Крім відомої вам так званої короткої форми зображення періодичної системи, використовується ще й «довга» форма, також запропонована самим Менделєєвим. Взагалі існує багато варіантів зображення періодичної системи і не тільки у вигляді таблиці. Але з табличних варіантів у наш час найбільш поширеними є коротка і довга форми. Вони взаємно доповнюють одна одну і в цілому ідентичні. Проте останнім часом довга форма набуває більшої популярності, оскільки яскравіше узгоджується з будовою атомів хімічних елементів.
У довгій формі (див. вклейку) великі періоди, так само як і малі, займають лише одну горизонталь, на два ряди не поділяються. Ліворуч розміщуються s-елементи, в атомах яких заповнюються s-орбіталі; праворуч —p-елементи, в атомах яких заповнюються p-орбіталі. У s- і p-елементів заповнюється зовнішній електронний шар. У середній частині великих періодів розміщуються так звані перехідні елементи, в атомах яких заповнюються d-орбіталі передзовнішнього шару. Родини лантаноїдів та актиноїдів — це f-елементи. В їхніх атомах заповнюється третій ззовні шар. Ці родини, як правило, виносять за межі таблиці, як у короткій, так і у довгій формі. Відмінність у послідовності заповнення електронних шарів (зовнішніх і розміщених глибше) пояснює причину різної довжини періодів.
Довга форма періодичної системи включає 16 груп—8 головних і 8 побічних (підгруп немає), що позначаються літерами А і Б. Розташування у групах 5- і p-елементів визначається загальною кількістю електронів зовнішнього шару, а d-елементів — загальною кількістю s-електронів зовнішнього і d-електронів передзовнішнього шарів. Періодична повторюваність будови зовнішніх електронних оболонок атомів є причиною періодичної зміни властивостей хімічних елементів. У цьому полягає фізична суть періодичного закону, яка не залежить від форми подання періодичної системи елементів.
Відкриття наприкінці XIX ст. електрона, радіоактивності, складності будови атома, елементарних частинок призвело до того, що багато які положення класичного атомно-молекулярного вчення довелося переглянути. Так, ще сам Д. І. Менделєєв говорив про атом тільки як про хімічно неподільну частинку.
