Сторінка
2
Найбільші родовища графіту утворилися внаслідок дії високих температур і тиску на кам'яне вугілля.
Вугілля, яке також складається з карбону, утворюється штучно. Проте в природі є речовини, що наближаються за своїм складом до вугілля. Такими є різні види викопного вугілля, що утворюють у багатьох місцях земної кулі потужні відклади. Деякі з видів викопного вугілля містять до 99% карбону.
Сполуки карбону дуже поширені. Крім викопного вугілля, у надрах Землі є великі скупчення нафти, що є складною сумішшю різних сполук, які містять карбон, переважно вуглеводнів. У земній корі трапляються у величезній кількості солі карбонової кислоти, особливо карбонат кальцію. У повітрі завжди є діоксид карбону. Нарешті, рослинні і тваринні організми складаються з речовин, з утворенні яких головну участь бере карбон. Отже, цей елемент один з найпоширеніших на Землі, хоча загальний вміст його у земній корі становить лише близько 0,1% (мас).
Щодо численності і різноманітності своїх сполук карбон займає серед інших елементів особливе положення. Число вивчених сполук карбону оцінюють тепер приблизно в два мільйони, тоді як сполуки всіх інших елементів, разом взяті, обчислюються лиш сотнями тисяч.
Різноманітність сполук карбону пояснюється здатністю його атомів зв'язуватися між собою з утворенням довгих ланцюгів або кілець.
Алотропія карбону. У вільному стані карбон відомий у вигляді алмазу, що кристалізується в кубічній системі, і графіту, що належить до гексагональної системи. Такі форми його, як деревне вугілля, кокс, сажа, мають невпорядковану структуру. Синтетично добуто карбін і полікумулен — різновидності карбону, що складаються з лінійних ланцюгових полімерів типу . —С=С—С==С . або .=С= =С=С= . . Карбін має напівпровідникові властивості. При сильному нагріванні без доступу повітря він перетворюється у графіт.
Алмаз — безбарвна, прозора речовина, яка сильно заломлює світлові промені. Він кристалізується в кубічній гранецентрованій решітці. При цьому одна половина атомів розміщується у вершинах і центрах граней одного куба, а друга — у вершинах і центрах граней другого куба, зміщеного відносно першого у напрямі його просторової діагоналі. Атоми карбону в алмазі перебувають у стані sр3-гібридизації і утворюють тривимірну тетраедричну сітку, у якій вони зв'язані один з одним ковалентними зв'язками 1. Відстань між атомами в тетраедрах дорівнює 0,154 нм. Структуру алмазу показано на мал. 1.
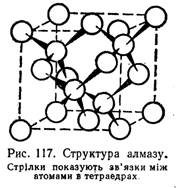
З усіх простих речовин алмаз має максимальне число атомів, що припадають на одиницю об'єму,— атоми карбону «упаковані» в алмазі дуже щільно. З цим, а також з великою міцністю зв'язку у карбонових тетраедрах, пов'язано те, що за твердістю алмаз переважає всі відомі речовини. Тому його широко застосовують у промисловості: майже 80% добутих алмазів використовують для технічних цілей. Його використовують для обробки різних твердих матеріалів, буріння гірських порід. Будучи дуже твердим, алмаз разом з тим крихкий. Порошок, який дістають при подрібненні алмазу, застосовують для шліфування дорогоцінного каміння і самих алмазів. Відшліфовані прозорі алмази називаються діамантами.
У зв'язку з великою цінністю алмазів було зроблено багато спроб добути їх штучно з графіту. Однак довго ці спроби закінчувалися невдачею. Лише в 1955 р., застосувавши дуже високий тиск (порядку 1010 Па) і тривале нагрівання при температурі близько 3000° С, американським, а одночасно і шведським вченим удалося добути синтетичні алмази. Якщо алмаз прожарювати в кисні, він згоряє, утворюючи діоксид карбону. Якщо алмаз сильно нагріти без доступу повітря, то він перетворюється на графіт.
Графіт являє собою темно-сірі кристали з слабким металічним піском. Він має шарувату решітку. Всі атоми карбону перебувають тут у стані sp2-гібридизації: кожний з них утворює три ковалентні зв'язки з сусідніми атомами, причому кути між напрямами зв'язків дорівнюють 120°. В результаті виникає плоска сітка, складена з правильних шестикутників, у вершинах яких розміщені ядра атомів карбону відстань між сусідніми ядрами становить 0,1415 нм.
В утворенні зв'язків беруть участь три електрони кожного атома карбону. Четвертий електрон зовнішнього шару займає 2р-орбіталь, яка не бере участі в гібридизації. Такі негібридні електронні хмари атомів карбону орієнтовані перпендикулярно до площини шару і, перекриваючись одна з одною, утворюють делокалізовані p-зв'язки. структуру графіту показано на рис. 118.
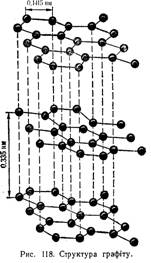
Сусідні шари атомів карбону в кристалі графіту перебувають на досить
великій відстані один від одного (0,335 нм); це свідчить про малу міцність зв'язку між атомами карбону, розміщеними в різних шарах. Сусідні шари зв'язані
між собою в основному силами Ван дер Ваальса, але частково зв'язок має металічний характер, тобто зумовлений «усуспільненням» електронів усіма атомами кристала 1. Цим пояснюється порівняно висока електропровідність і теплопровідність графіту не тільки в напрямі шарів, а й в перпендикулярному до них напрямі .
Розглянута структура графіту зумовлює сильну анізотропію його властивостей. Так, теплопровідність графіту у напрямі площини шарів дорівнює 4,0 Дж/(см • с • К), а в перпендикулярному напрямі становить 0,79 Дж/(см • с • К). Електричний опір графіту в напрямі шарів у 104 раз менший, ніж у перпендикулярному напрямі.
Окремі шари атомів у кристалі графіту, зв'язані між собою порівняно слабко, легко відокремлюються один від одного. Цим пояснюється мала механічна міцність графіту. Якщо провести шматком графіту по папері, то дрібнесенькі кристалики графіту, що мають вигляд лусочок, прилипають до паперу, лишаючи на ньому сіру риску. На цьому грунтується застосування графіту для виготовлення олівців.
На повітрі графіт не загоряється навіть при сильному розжарюванні, але легко згоряє у чистому кисні, перетворюючись у діоксид карбону.
Завдяки своїй електропровідності графіт застосовується для виготовлення електродів. З суміші графіту з глиною роблять вогнетривкі тиглі для плавлення металів. Змішаний з мастилом графіт є чудовим мастильним засобом, оскільки його лусочки, заповнюючи нерівності матеріалу, створюють гладку поверхню, що полегшує ковзання. Графіт застосовують також як уповільнювач нейтронів у ядерних реакторах.
Крім природного у промисловості застосовують штучний графіт. Його добувають в основному з кращих сортів кам'яного вугілля. Перетворення відбувається при температурах близько 3000° C в електричних печах без доступу повітря.
Графіт термодинамічно стійкий у широкому інтервалі температур і тисків, зокрема за звичайних умов. У зв'язку з цим при розрахунках термодинамічних величин як стандартний стан карбону беруть графіт. Алмаз термодинамічно стійкий лише при високих тисках (вище за 109 Па). Але швидкість перетворення алмазу в графіт стає помітною лише при температурах вище 1000° С; при 1750° C перетворення алмазу в графіт відбувається швидко.
