Сторінка
6
Величина теплового ефекту залежить від природи вихідних речовин і продуктів реакції, від їх агрегатного стану, а також від температури і тиску.
Оскільки більшість хімічних реакцій проводять за сталого тиску, основну увагу ми приділятимемо ізобарним процесам.
Для визначення теплових ефектів застосовують прилади калориметри.
В основі термохімічних розрахунків лежить закон, відкритий російським ученим Г. І. Гессом у 1840 р. Цей закон формулюється так: тепловий ефект реакції залежить тільки від початкового та кінцевого станів вихідних речовин та продуктів реакції і не залежить від проміжних стадій прогресу. Цей закон іноді називають другим законом термохімії. Закон Гесса справедливий лише за умови сталого тиску або об'єму.
Закон Гесса дає змогу обчислювати теплові ефекти в тих випадках, коли їх неможливо виміряти безпосередньо. Покажемо це на прикладі добування оксиду карбону(ІІ) з графіту. Виміряти тепловий ефект реакції утворення оксиду карбону(П) з графіту і кисню дуже важко, оскільки під час згоряння графіту утворюється суміш СО + СО2 (у разі недостатньої кількості кисню). Теплоту утворення СО можна обчислити, знаючи теплоту (ентальпію) згоряння (-283,0 кДж/моль) і теплоту (ентальпію) утворення оксиду карбону(ІV) (-393,5 кДж/моль).
Термохімічне рівняння згоряння графіту
С (графіт) + О2 (г) = СО2 (г), ![]() = -393,5 кДж
= -393,5 кДж
можна записати у дві стадії:
С (графіт) + ½О2 (г) = СО (г), ![]() = х кДж;
= х кДж;
СО (г) + ½O2 (г) = СО2 (г), ![]() =-283,0 кДж.
=-283,0 кДж.
Записавши термохімічні рівняння, що відповідають цим стадіям дістанемо сумарне рівняння:
С (графіт) + О2 (г) = СO2 (г), ![]() = (х + 283,0) кДж.
= (х + 283,0) кДж.
Тепловий ефект сумарної реакції (згідно з законом Гесса) дорівнює тепловому ефекту реакції безпосереднього згоряння графіту, тобто
(х + 283,0) кДж = 393,5 кДж, звідки х = 110,5 кДж.
Отже, термохімічне рівняння утворення оксиду карбону(ІІ) можна записати так:
С (графіт) + ½О2 (г) = СО (г), ![]() = - 110,5 кДж.
= - 110,5 кДж.
Із закону Гесса, який є одним із висновків закону збереження енергії, випливає два важливих наслідки: 1) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот утворення ![]() продуктів реакції з відніманням суми стандартних теплот утворення вихідних речовин; 2) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот згоряння
продуктів реакції з відніманням суми стандартних теплот утворення вихідних речовин; 2) стандартний тепловий ефект реакції дорівнює сумі стандартних теплот згоряння ![]() вихідних речовин з відніманням суми стандартних теплот згоряння продуктів реакції. Перший наслідок має загальне значення, другий важливий для органічних сполук.
вихідних речовин з відніманням суми стандартних теплот згоряння продуктів реакції. Перший наслідок має загальне значення, другий важливий для органічних сполук.
Так, для реакції взаємодії газоподібного SО3 і кристалічного А12О3
А12O3 (к) + 3SO3(г) = А12(SO4)3 (к)
тепловий ефект реакції визначається залежністю
![]()
Згідно з даними табл. 6, тепловий ефект цієї реакції становить
![]() = -753,3 кДж.
= -753,3 кДж.
За законом Гесса розраховано стандартні теплоти утворення багатьох сполук. Крім цього, за законом Гесса обчислені теплові ефекти хімічних реакцій без проведення спеціальних досліджень. Закон Гесса відіграв велику роль у розвитку не тільки термохімії, а й більш широкої галузі науки — хімічної термодинаміки.
БУФЕРНІ РОЗЧИНИ
У хімії, біології, медицині, у промисловому виробництві для перебігу тих або інших процесів часто потрібно забезпечувати сталість значень рН, в ході ж реакцій йони Гідрогену можуть зв'язуватись або виділятись. Щоб процес відбувся за сталого значення рН, у розчин вводять так звані буферні розчини, які здатні зв'язувати йони Гідрогену або гідроксид-іони і підтримувати рН розчину практично незмінним.
Буферні розчини — це суміші розчину слабкої кислоти (або слабкої основи) та її солі, наприклад, суміш ацетатної кислоти й ацетату натрію СН3СООН + СН3СОONa, суміш гідроксиду і хлориду амонію NН4ОН + NH4Cl тощо.
У разі добавляння до буферних розчинів розчину сильної кислоти або сильної основи відбуваються такі реакції:
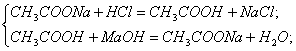
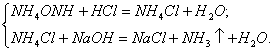
Отже, під дією на буферний розчин розчину сильної кислоти або сильної основи змінюється концентрація розчину слабкої кислоти або слабкої основи. Проте рН буферного розчину практично не змінюється. Це пояснюється тим, що слабка кислота або слабка основа взагалі мало дисоціює, а за наявності однойменних йонів її солі дисоціація відбувається ще меншою мірою. Тому рН буферного розчину під дією сильної основи або сильної кислоти практично залишається сталим.
Не змінюється рН буферного розчину й під час розбавляння, оскільки його рН залежить лише від співвідношення концентрації солі сс та кислоти ск і не залежить від ступеня розбавляння, що підтверджується формулою, за якою обчислюють рН буферного розчину:
![]()
За формулою
![]()
можна обчислити рОН буферного розчину, що складається з розчину слабкої основи та її солі.
Буферні розчини часто використовують у хімічній промисловості в якісному та кількісному аналізах, коли потрібно провести реакцію за певного значення рН.
У хімічному аналізі використовують також і інші буферні розчини, такі як суміш боратної кислоти і борату натрію, гідроген- і дигідрогенфосфатів калію, тартратної кислоти та її солі, цитратної кислоти та її солі тощо.
