Сторінка
2
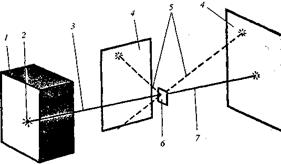
Рис. 1. Схема досліду Е. Резерфорда з розсіювання ![]() -частинок
-частинок
Виходячи з цих міркувань, Е. Резерфорд у 1911 р. запропонував так звану ядерну (планетарну) модель будови атома, згідно з якою атом складається з позитивно зарядженого ядра, в якому зосереджена майже вся маса атома, та електронів, які обертаються навколо ядра. Сумарний негативний заряд електронів чисельно дорівнює позитивному заряду ядра. Діаметр ядра у 10 000 — 100 000 разів менший, ніж діаметр атома в цілому.
Е. Резерфорд обчислив також і заряд ядра. З його дослідів виходило, що заряд ядра (виражений в одиницях заряду електрона) чисельно дорівнює протонному числу елемента в періодичній системі. Пізніше (1913 р.) це підтвердив Г. Мозлі (закон Мозлі), виявивши простий зв'язок між довжинами хвиль певних ліній рентгенівського спектра елемента і його протонним числом: корінь квадратний із обернених значень довжин хвиль (тобто частот певних ліній спектра) однакових серій характеристичного рентгенівського спектра перебуває в лінійній залежності від протонного числа елемента:
![]()
де ![]() — довжина хвилі власного випромінювання елемента; а, b — константи, що залежать від лінії та серії спектра; Z — протонне число елемента.
— довжина хвилі власного випромінювання елемента; а, b — константи, що залежать від лінії та серії спектра; Z — протонне число елемента.
Закон Мозлі давав змогу визначати точні значення протонних чисел маловивчених і ще не відкритих елементів і тим самим сприяв розвитку періодичного закону.
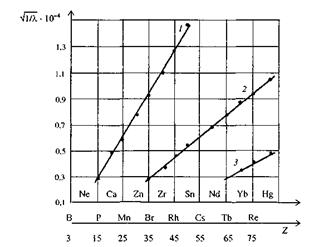
Рис. 2. Залежність частоти характеристичного випромінювання рентгенівських спектрів елементів від їхніх протонних чисел:
1 — лінії а серії К (Ка); 2 — серії L (Lа); 3 — серії М (Ма)
На рис. 2 наведено залежність частоти характеристичного випромінювання рентгенівських спектрів добре вивчених елементів від їхніх протонних чисел. Щоб знайти протонне число не точно визначеного у природному ряду елемента, потрібно обчислити для нього частоту лінії Ка і зіставити отриману величину з графіком (див. рис. 2). Закон Мозлі дав змогу встановити, що між елементами Гідрогеном і Ураном розміщено 92 елементи і з якими саме протонними числами елементи будуть відкриті.
Англійський вчений Д. Чедвік у 1920 р. за розсіюванням ![]() -частинок з великою точністю визначив заряди атомних ядер деяких елементів. Зроблені ним обчислення показали, що заряди ядер атомів різних елементів в усіх випадках збігаються з величиною 2 у формулі закону Мозлі.
-частинок з великою точністю визначив заряди атомних ядер деяких елементів. Зроблені ним обчислення показали, що заряди ядер атомів різних елементів в усіх випадках збігаються з величиною 2 у формулі закону Мозлі.
Протонне число є дуже важливою характеристикою елемента, воно виражає позитивний заряд ядра його атома. Виходячи з електронейтральності атома, можна дійти висновку, що й число електронів, які обертаються навколо ядра, дорівнює протонному числу елемента. Отже, заряд атомного ядра є тією основною величиною, від якої залежать властивості елемента і його розміщення в періодичній системі. Тому періодичний закон Менделєєва слід формулювати так: властивості елементів, а також утворених ними простих і складних речовин перебувають у періодичній залежності від величини зарядів ядер атомів елементів.
ДИСОЦІАЦІЯ ВОДИ. ВОДНЕВИЙ ПОКАЗНИК
Вода — дуже слабкий електроліт, який частково дисоціює на гідроксид-іони ОН - та йони Гідрогену Н +:
![]()
Застосувавши до рівняння дисоціації води закон дії мас, дістанемо
![]()
Де ![]() — константа дисоціації води; [Н2О] — концентрація недисоційова-них молекул води, що перебувають у стані рівноваги з йонами Гідрогену і гідроксид-іонами.
— константа дисоціації води; [Н2О] — концентрація недисоційова-них молекул води, що перебувають у стані рівноваги з йонами Гідрогену і гідроксид-іонами.
Оскільки дисоційованих молекул води надзвичайно мало, порівняно із загальною кількістю молекул води, ними можна знехтувати. Отже, концентрацію не дисоційованих молекул води можна вважати сталою величиною, яку легко обчислити. Для цього слід масу 1 л води поділити на її молярну масу:
![]()
і тоді
[Н+][ОН-] = 1,8 • 10-16 • 55,56 ![]() 10-14;
10-14; ![]() = 10-14.
= 10-14.
Отже, добуток концентрацій йонів Гідрогену і гідроксид-іонів за сталої температури є сталою величиною. Ця величина /н 0 називається йонним добутком води. За температури 22 °С ![]() = 10-14. Значення йонного добутку води змінюється із зміною температури, оскільки з підвищенням температури ступінь дисоціації води зростає. Так, за температури 100 °С йонний добуток води становить 0,58 • 10-12.
= 10-14. Значення йонного добутку води змінюється із зміною температури, оскільки з підвищенням температури ступінь дисоціації води зростає. Так, за температури 100 °С йонний добуток води становить 0,58 • 10-12.
У чистій воді концентрація йонів Гідрогену дорівнює концентрації гідроксид-іонів:
![]()
Якщо до води добавити розчин якої-небудь кислоти, тобто ввести додаткову кількість йонів Гідрогену, то стан йонної рівноваги води порушиться. Збільшення концентрації йонів Гідрогену приведе до відповідного зменшення концентрації гідроксид-іонів, а добуток концентрацій цих йонів залишиться сталою величиною. Так, в 0,001 М розчині хлоридної кислоти концентрація йонів Гідрогену дорівнює загальній концентрації кислоти ![]() , тобто [Н+]= 10-3 моль/л. Концентрацію гідроксид-іонів можна обчислити за рівнянням
, тобто [Н+]= 10-3 моль/л. Концентрацію гідроксид-іонів можна обчислити за рівнянням
![]() звідки
звідки
![]() моль/л.
моль/л.
У розчинах лугів концентрація йонів Гідрогену значно менша, ніж концентрація гідроксид-іонів. У 0,001 М розчині їдкого натру ![]() концентрація гідроксид-іонів [ОН -] = 10-3 моль/л, а концентрація йонів Гідрогену
концентрація гідроксид-іонів [ОН -] = 10-3 моль/л, а концентрація йонів Гідрогену
![]() моль/л.
моль/л.
