Сторінка
2
Із наведених рівнянь випливає, що на кожний моль суперфосфату припадає 2 моля фосфогіпсу, відтак на 1t суперфосфату вихід гіпсу становить:
![]()
![]()
40 + 2 × (2 + 31 + 4 × 16) = 234 — 2 × (40 + 32 + 4 × 16) = 272
1 t суперфосфату — х![]()
![]() гіпсу.
гіпсу.
Виробництво суперфосфату в деякі роки на Україні становило близько 10 млн t. Отже, багатомільйонні відходи гіпсу, насичені сірчаною кислотою, ставлять складну екологічну проблему перед сучасним виробництвом фосфорних добрив.
Друге, надзвичайно важливе виробництво добрив — азотно-тукове, в основі якого лежить перша стадія процесу «зв’язування» атмосферного азоту в аміак. Хімічна реакція цього процесу на вигляд надзвичайно проста N2 + 3H2 ![]() 2NH3 + 92 kJ, але саме вона є прикладом того, як людство завдяки науковому пошуку вирішує сучасні глобальні проблеми.
2NH3 + 92 kJ, але саме вона є прикладом того, як людство завдяки науковому пошуку вирішує сучасні глобальні проблеми.
До початку першої світової війни основним азотним добривом була натрієва селітра (NаNО3), природні поклади якої є обмеженими. Основну масу натрієвої селітри завозили у Європу з Південної Америки, з Чилі, завдяки чому вона більш відома під назвою «чилійська селітра». Звичайно, доставка селітри з-за океану збільшувала її ціну, що негативно впливало на рівень економічної ефективності її застосування в сільському господарстві та промисловості. Додамо, що в ті часи натрієва селітра широко застосовувалась для виробництва азотної кислоти (за реакцією NаNО3 + H2SO4 = 2HNO3 + Na2SO4), яка, у свою чергу, використовувалась у процесі виготовлення пороху й вибухівки.
У великій кількості ще в минулому сторіччі азотовмісну речовину, яку можна було використати як добриво чи вихідний напівпродукт у хімічному виробництві, отримували за коксування вугілля. Кам’яне вугілля містить до 2% азоту й кілька відсотків водню. У процесі коксування вугілля ці елементи поєднуються в сполуку NН3 — аміак і її похідну — солі амонію (N![]() ), наприклад (NН4)2SO4. Відокремлення аміаку й солей амонію від інших продуктів коксування досягається пропусканням коксового газу через воду. Така вода одержала назву «аміачна вода» і знайшла застосування як перше азотне добриво хімічного виробництва. Нагріванням аміачної води з вапном аміак можна було виділити в чистому вигляді як газ, що й було єдиним промисловим методом його одержання до початку ХХ ст.
), наприклад (NН4)2SO4. Відокремлення аміаку й солей амонію від інших продуктів коксування досягається пропусканням коксового газу через воду. Така вода одержала назву «аміачна вода» і знайшла застосування як перше азотне добриво хімічного виробництва. Нагріванням аміачної води з вапном аміак можна було виділити в чистому вигляді як газ, що й було єдиним промисловим методом його одержання до початку ХХ ст.
Обмежені запаси природної селітри й незначні потужності аміачного виробництва коксохімічної технології спонукали науковців і виробничників до інтенсивних пошуків економічно ефективніших промислових методів одержання аміаку, який уже був відомий як хімічно активна і зручна сполука для її використання в різних хімічних процесах виробництва добрив, барвників і військової продукції (пороху, динаміту, тринітротолуолу).
Початок першої світової війни значно загострив потреби в азотній кислоті, яка була особливо необхідною Німеччині, блокованій Антантою. Німецькі хіміки Фріц Габер і Карл Бош завершили багаторічні пошуки видатних хіміків свого часу — здійснили синтез аміаку за тією простою реакцією, з якої ми почали цю тему. Але це не було просто. Треба було визначити термодинамічні умови перебігу реакції і знайти відповідні параметри процесу і каталізатори.
Свідченням значення цього видатного науково-технічного досягнення для прогресу цивілізації є визнання його вченим світом — Ф. Габер і К. Бош були удостоєні Нобелівської премії. Принципи технології синтезу аміаку, розроблені цими вченими, не змінилися до нашого часу в системі технологій отримання азотних добрив й описані в кожному підручнику з хімії. Значно змінилися апаратурне оформлення і параметри процесу.
У сучасному технологічному процесі синтезу аміаку найчастіше тиск у системі підтримують близьким до 30 МРа, а температуру 400 … 500°С. У зв’язку з високими тиском і температурою конструювання й виготовлення апарата синтезу аміаку становить складну проблему.
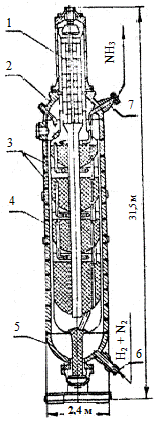
Перші апарати — колони синтезу виготовляли із стальних заготовок у Німеччині після першої світової війни на військових заводах Круппа за такою технологією, як і для крупнокаліберних гарматних стволів. З часом розміри колон збільшувались і змінювалась технологія їх виготовлення. Сучасна колона синтезу — це великогабаритний апарат каталітичного синтезу аміаку безперервної дії (рис. 62). Унизу до колони надходить азотно-воднева суміш, а згори виходять продукти реакції — аміак (близько 20%) і вихідні реагенти (Н2 і N2), які не прореагували. Після відокремлення аміаку водень і азот знову повертаються в колону синтезу.
|
Технічна характеристика Виробництво за добу, t . 1360 Внутрішній діаметр, мм: корпусу колони 2400 теплообмінника 1000 Робочий тиск, kgs/sm2 32 Максимально допустима температура стінки корпусу, °С 250 Внутрішній об’єм корпусу, м2 . 96,6 Загальна висота колони, мм 31450 Маса оснащеної колони, t 510 Колона синтезу аміаку: 1 — теплообмінник; 2 — верхнє днище колони; 3 — рулоновані блоки центральної обичайки корпусу; 4 — внутрішня насадка з каталізатором; 5 — нижнє днище колони; 6 — вхідний штуцер; 7 — вихідний штуцер Рис. 62. Колона синтезу аміаку |
|