Сторінка
4
Ознайомлення із зразками сірки та її природних сполук
Розгляньте видані вам зразки сірки та її природних сполук. Для кожного з них запишіть у зошит: 1) назву, 2) хімічну формулу, 3) агрегатний стан, 4) колір,
5) твердість.
Ви довідались, що в природі дуже поширені сполуки Сульфуру з різними металами. Багато з них є цінними рудами: РbS — свинцевий блиск, ZnS — цинкова обманка, Сu2S — мідний блиск, FeS2 — залізний колчедан, або пірит. Поширені в природі й інші мінерали Сульфуру, в основному сульфати кальцію і магнію. Поклади сполук Сульфуру є в Україні (Львівська область), Туркменістані, Італії, Японії, США та ін.
§ 3. ХІМІЧНІ ВЛАСТИВОСТІ КИСНЮ І СІРКИ
Ви вже знаєте, що кисень — дуже реакційноздатна речовина. Він реагує з багатьма металами, неметалами багатьма складними речовинами, виявляючи властивості сильного окисника.
Хімічна активність сірки також доволі висока. При нагріванні вона реагує майже з усіма елементами (у формі простих речовин) і з багатьма складними речовинами, виявляючи при цьому властивості як окисника, так і відновника (порівняйте з киснем), бо для неї характерні як позитивні ступені окиснення (+4, +6), так і негативний (-2).
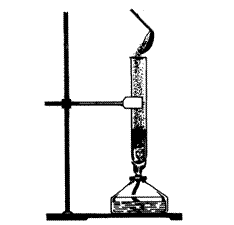
1. Взаємодія з металами. Сірка як типовий неметал взаємодіє з багатьма металами (окрім золота), утворюючи сульфіди. Так, якщо всипати порошок міді у розплавлену сірку (мал. 3), то відбувається реакція з утворенням чорного сульфіду купруму (І) і виділенням великої кількості теплоти:
2Сu + S = Сu2S
Після початку реакції спиртівку відставляють.
2. Взаємодія з неметалами. Сірка безпосередньо взаємодіє з усіма неметалами (окрім йоду й азоту). Реакції відбуваються при нагріванні:
S + O2 = SO2
 H2 + S = H2S
H2 + S = H2S
Застосування. Найбільша маса сірки і природних сульфідів витрачається на виробництво сульфатної кислоти. Сірка використовується і в інших галузях хімічної промисловості: для добування сульфітів Nа2SO3 і Са(НS03)2 для легкої
промисловості, сульфідів Nа2S, СаS,
Мал. 3. Взаємодія міді і сірки ВаS для шкіряного виробництва, виготовлення люмінофорів (речовин, здатних світитися). Сірку застосовують у виробництві барвників, гуми, чорного пороху, сірників, ліків, використовують її і в сільському господарстві для боротьби із шкідниками.
§ 4. ОКСИДИ СУЛЬФУРУ
Сульфур утворює два кислотні оксиди: оксид сульфуру (IV) SO2 і оксид сульфуру(VІ) SO3. Різний кількісний склад молекул (і різна їхня будова) зумовлюють відмінні властивості цих речовин.
Оксид сульфуру (ІV) SO2(діоксид сульфуру, сірчистий газ) —це безбарвний важкий газ (у 2,2 раза важчий за повітря), з різким запахом, що викликає кашель. Негорючий. Дуже легко розчиняється у воді ( в 1л води при 20 °С розчиняється 43 л SO2 ). Поряд з «фізичним» розчиненням одночасно відбувається хімічна взаємодія Невеликої частини молекул оксиду сульфуру (ІV) SO2 з водою, внаслідок чого утворюється сульфітна кислота:
Сульфітна кислота Н2SO3 —дуже нетривка сполука. Існує тільки у водних розчинах. За спроб виділити її розкладається на оксид сульфуру (ІV) і воду. Легко поглинає з повітря кисень і повільно окиснюється у сульфатну кислоту:
2H2SO3 + O2 = 2H2SO4
Сульфітна кислота Н2SO3 двохосновна. Належить до кислот середньої сили. У водному розчині дисоціює ступінчасте, в основному за першим ступенем:
гідросульфіт-іон
сульфіт-іон
За другим ступенем дисоціація відбуваєтьсянезначноюмірою.
Як двохосновна сульфітна кислота Н2SO3 може утворювати два ряди солей:
а) середні солі —сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал).
Якщо в розчин їдкого натру NаОН пропускати сірчистий газ SO2, то залежно від співвідношення речовин, що реагують, утвориться або середня, або кисла сіль:
NаОН + SО2 = NаНSO3
1 моль 1 моль гідросульфіт натрію
2NаОН + SO2 = Nа2SO3 +H2O
2 моль 1 моль сульфіт натрію
Це слід брати до уваги під час виконання дослідів та розв'язування задач.
Усі сульфіти—нерозчинні солі, за винятком сульфітів лужних металів і амонію.
Добування. Оксид сульфуру (IV) добувають спалюванням сірки, а також як побічний продукт випалювання сульфідних руд кольорових металів, наприклад:
