Сторінка
2
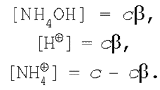
Підставимо ці вираження в рівняння для константи гідролізу (5):
![]()
Скориставшись рівнянням (6), одержимо:
![]()
Перетворимо рівняння (7):
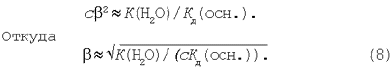
3. Сіль, утворена слабкою кислотою і слабкою основою. Рівняння гідролізу солі ціаніду амонію в молекулярній і іонній формах:
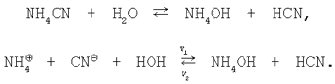
Застосуємо закон діючих мас до даного оборотного процесу:
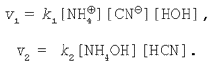
У стані хімічної рівноваги швидкість прямої реакції дорівнює швидкості зворотної реакції:
![]()
Константа хімічної рівноваги – це відношення константи швидкості прямої реакції до константи швидкості зворотної реакції:
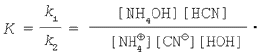
Як і в попередніх випадках, об'єднаємо K і [НОН]:
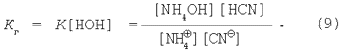
Помножимо чисельник і знаменник у рівнянні (9) на величину іонного добутку води:
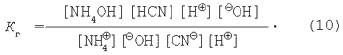
Знаючи, що
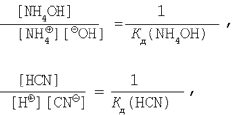
перетворимо вираження для константи гідролізу (10).
У результаті одержимо:
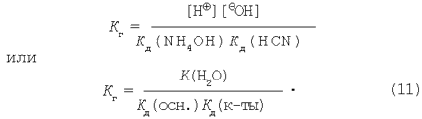
Виразимо ступінь гідролізу солі, утвореним слабкою кислотою і слабкою основою.
Нехай вихідна концентрація солі ціаніду амонію в реакції гідролізу дорівнює с. Вихідні концентрації катіона амонію і ціаніду-аніона також можна вважати рівними з (пам'ятаючи, що сіль – сильний електроліт). Тоді рівноважні концентрації приймуть значення:
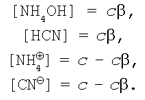
Підставляючи вираження рівноважних концентрацій у рівняння константи гідролізу (9) одержимо:
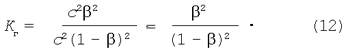
Дорівнюємо праві частини рівнянь (11) і (12):
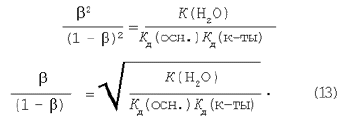
З рівнянь (4), (8), (13) випливає, що ступінь гідролізу тим більше:
· чим більше величина ДО(H2O), тобто чим вище температура, тому що іонний добуток води зростає з підвищенням температури;
· чим менше константи дисоціації Кд електролітів, що утворять сіль, тобто чим слабкіше електроліти, залишки яких входять до складу солі;
· чим менше концентрація солі в розчині, тобто чим більше ступінь розведення розчину (висновок випливає з рівнянь (4) і (8)).
Наприклад, при додаванні до розчину хлориду сурми(III) дистильованої води спостерігається утворення осаду SbOCl, що свідчить про протікання реакції гідролізу солі SbCl3 по другій ступіні. Саме друга ступінь гідролізу хлориду сурми(III) приводить до утворення основної солі Sb(ВІН)2Сl, розкладання якої і дає осад хлориду оксосурьми.
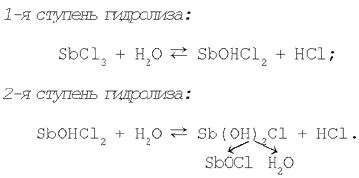
Таким чином, розбавляючи розчин, зміщаємо рівновага реакції гідролізу вправо.
Якщо гідроліз – явище небажане, то працювати потрібно з концентрованими розчинами при знижених температурах. Корисно також додати до розчину солі надлишок одного з продуктів, що утворяться при гідролізі, ( кислоти чи луги, у залежності від реакції середовища розчину), тим самим сприяючи зсуву хімічної рівноваги реакції уліво відповідно до принципу Ле Шателье.
Так, якщо до розчину з осадом Sbосl долити соляну кислоту, то осад розчиниться. Якщо потім знову в розчин додати воду, то спостерігається повторне утворення осаду.
Описані явища погодяться з раніше зробленими висновками про вплив розведення розчину на ступінь гідролізу, а також підтверджують оборотний характер процесу і можливість зсуву хімічної рівноваги реакції гідролізу.
1 2
