Сторінка
6
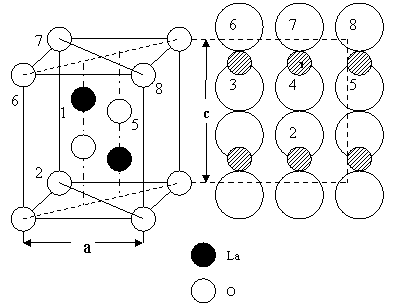
Елементарна комірка La2 O 3
і проекція положень атомів на площину;а=3,945 Ǻ; с=6,151 Ǻ, La↔O=2,43 Ǻ
Оксид Лантану утворює показану на ілюстрації гексагональну шарувату будову, що видно із, власне, правої частини малюнка, яка є проекцією положень атомів на площину ас. Кожний атом La обмежений майже на рівній відстані атомами О. Ізотипами La2O3 є оксид Церію, Празеодиму та Неодиму, а також інтерметалічні сполуки Mg3Bi2 та Mg3Sb2[9]. La2O3 – тугоплавкий, парамагнітний. термічно стійкий, надзвичайно реакційно здатний, дуже активно взаємодіє з водою, аналогічно до CaO, перетворюючись у La2O3*nH2O. Процес «гасіння» сильно екзотермічний:
La2O3 + 3H2O → 2La(OH)3 , ∆H<<0.
Тпл. = 2300 оС
Ткип. = 4300 оС
До 2040оС стійкий А- La2O3 з гексагональною ґраткою (а=0,39373 нм, с=0,61299 нм, z=1, густ. 6,57 г/см3), при 2040-2110 оС Н- La2O3 з гексагональною ґраткою, при 2100-2313 оС – Х- La2O3 з кубічною ґраткою, ∆Hутв. = -1794,2 кДж/моль, ∆S298. = 127,3 Дж/моль*K.
Взаємодіє з HCl, HNO3, HClO4. У вологому повітрі швидко перетворюється у гідрат оксикарбонату Лантану. La2O3 - проміжний продукт при виробництві LaF3 і інших сполук Лантану, La2О3 став важливим компонентом оптичного скла, керамічних матеріалів, у т.ч. високотемпературних напівпровідників Фотооб'єктиви знаменитої фірми "Кодак" містять від 20 до 40% La2O3. Завдяки добавкам лантану вдалося зменшити розміри об'єктива при тій же світловій силі, набагато поліпшити якість кольорової зйомки. Відомо, що під час Другої світової війни лантанове скло застосовували в польових оптичних приладах. Останнім часом лантанове скло йде також на виготовлення лабораторного посуду. Оксид лантану додає склу не тільки коштовні оптичні властивості але і велику термостійкість і кислотостійкість.
Хімічні властивості La2O3
La2O3+3H2O(гар.)= 2La(ОН)3![]()
La2O3+6HCl(розб.)= 2LaСl3+ 3 H2О
La2O3+ H2O +2СO2= 4La СO3 (ОН) (кімн.)
La2O3+ 3 H2S +C(кокс) = La2S3+3 H2![]() +3СО (1000оС)
+3СО (1000оС)
La2O3+ 6HF= 2LaF3 + 3H2O (400-500 оС)
La2O3+C(кокс) + 3Сl2= 2LaCl3+3СО↑ (800 - 900 оС)
7.2.Гідроксид Лантану La(OH)3
Гідроксид Лантану La(OH)3 одержується у вигляді слизоподібних білих осадів при додаванні до розчинів відповідних солей розчинів лугів або аміаку. Це біла, аморфна, нерозчинна у воді речовина.
Він розчинний у надлишку осаджувачів і висихає на повітрі у фарфороподібну масу, складу, що відповідає правильного стехіометричного складу. рН початку осадження La(OH)3 або основних солей типу La(OH)2,5Cl0,5 ,близький до 8.
La(OH)3 - сильна основа, що жадібно притягує із повітря СO2 та витісняє аміак із солей амонію. При нагріванні гідроксид спочатку переходить у метагідроксид LaО(OH) і вже потім , при більш інтенсивному нагріванні, відбувається відщеплення води із утворенням оксиду.[9].
Хімічні властивості La(OH)3
2La(ОН)3= La2O3+3H2O (300-1100 оС)
La(ОН)3(тв.) =LaО(ОН)(тв.)+ H2O(р.) (↑700 оС, в конц. NaOH)
La(ОН)3+3HCl(розб.) = LaСl3+ 3 H2О
La(ОН)3(суспенз.)+3СO2 = 4La2 (СO3 )3↓+ 3 H2О
Гідроксид Лантану – порівняно сильна основа, по активності подібна до гідроксидів лужноземельних металів.
7.3.Сполуки Лантану з
різними елементами та солі.
Лантану трифторид - LaF3 - кристалічна речовина із тригональною ґраткою (у гексагональній установці); Тпл. = 1493оС Ткип. = 2300оС, ∆Hутв. = -1699 кДж/моль, ∆S298. = 100 Дж/моль*K, нерозчинний у воді, утворює кристалогідрати. Гідрати одержують осадженням із водних розчинів солей Лантану дією фтороводневої кислоти, безводну сіль – взаємодією La2O3 з газоподібним HF або F2, розкладом фторамонійних комплексів при 400-500оС. Застосовують для одержання металічного Лантану. Монокристали LaF3 – селективні електроди по відношенню до йонів F- .
Безводний хлорид лантануутворюється при нагріванні змішаного з вугіллям оксиду у потоці хлору, або взаємодією суміші ССl4 і С з оксидом лантану чи оксалатом лантану. Застосовується для одержання La і його сполук. LaCl3 представляє собою розпливчаті кристали з гексагональною кристалічною решіткою густиною 3,818. Тпл.=862оС, Ткип. = 1710 оС . Із водного розчину зазвичай викристалізовується гідрат з сімома молекулами води. Гідроліз у 0,1н. розчині при 14 оС складає 0,003%. При зневодненні гідрату хлориду також легко відбувається відщеплення HCl.
Схильність до утворення подвійних хлоридів із хлоридами лужних металів незначна. Подвійний хлорид Лантану і піридинію [C5H5NH]3La2Cl9*C2H5OH був одержаний із спиртового розчину. Безводний LaCl3, кристалізується аналогічно до фториду, у гексагональній решітці. Те саме відноситься і до LaBr3 . Навпаки ж, LaІ3 кристалізується у ромбічній решітці.
Хімічні властивості:
LaСl3*7H2O = La(Cl)O + 2HCl + 6H2O (91-400°C)
LaСl3(розб.) + 8H2O = [La(H2O)8]3+ + 3Cl- (pH<7)
LaСl3 + 2H2O = LaCl (OH)2↓ + 2HCl (кип.)
LaСl3 + NaOH (розб.,хол.) = La(ОН)3↓ + 3NaCl
LaСl3 + NH3*H2O(розб.) = La(ОН)3↓ + 3NH4Cl
2LaСl3 (конц.) + H2SO4(конц.) = La2(SO4)3 + 6HCl
LaСl3 + 3HF(конц.) = LaF3↓ + 3HCl
