Сторінка
3
Дані про розподіл металів серед комплексних сполук з РОР, що мають різну молекулярну масу, підтверджують виключно важливу роль ГР у їх зв`язуванні (рис. 4). Основна частка зв’язаних металів – від 48,5 до 79,6 % – сконцентрована у фракції з найменшою молекулярною масою. Якщо врахувати, що молекулярна маса переважної частини ФК у водосховищах Дніпра не перевищує 1000 Да, то цілком вірогідно, що саме ця фракція ФК зв’язує метали найбільше.
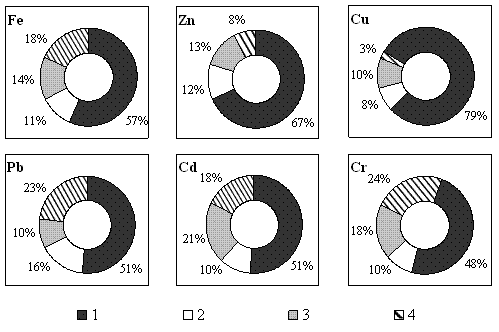
Рис. 4. Співвідношення різних за молекулярною масою органічних комплексних сполук металів у воді Київського водосховища у весняний період 1994–1998 рр.: 1 – 0,25–5 тис. Да, 2 – 5–20 тис., 3 – 20–60 тис., 4 – >60 тис. Да.
Кінетика комплексоутворення. Швидкість зв’язування іонів металів у комплекси з РОР поверхневих вод слід розглядати як важливий фактор з екологічної точки зору. Більш швидке комплексоутворення є запорукою того, що токсичність металів знижуватиметься внаслідок зменшення концентрації їх вільних іонів як найбільш токсичної форми. Результати наших багаточисленних досліджень показали, що зв’язування металів у комплекси з РОР відбувається досить повільно. При цьому швидкість комплексоутворення залежить, перш за все, від концентрації металу, який вноситься в пробу води, а також від компонентного складу природних органічних речовин, що зазнає сезонних змін. При підвищенні концентрації досліджуваного металу в природній воді зв’язування його в комплекси відбувається з більшою швидкістю і в більшій кількості. Раніше ми вважали, що рівновага в системі в таких умовах досягається за декілька діб [9]. Але результати більш поглиблених досліджень показали, що повної рівноваги в системі не вдається досягнути за декілька діб навіть за наявності високих значень концентрації металів, що обумовлено, мабуть, специфікою ГР як макромолекулярних лігандів. Якщо порівняти дані про кінетику комплексоутворення металів (на прикладі міді та цинку)у різні пори року, можна переконатись, що найменша швидкість зв’язування характерна для весняного періоду. В більшості випадків вона залишається достатньо низькою і в першій половині літа (рис. 5, крива 1).
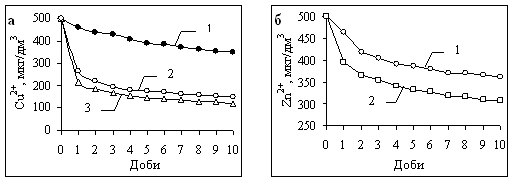
Рис. 5. Кінетика комплексоутворення Cu (II) та Zn (II) у воді верхньої ділянки Канівського водосховища. а: 1 – червень, 2 – серпень, 3 – листопад; б: 1 – квітень, 2 – жовтень.
Наприклад, практично повне зв’язування міді в комплекси з РОР води верхньої ділянки Канівського водосховища у червні 1998 року досягалось лише через три місяці після її внесення в систему (рис. 6а, крива 1). Для порівняння нами також була вивчена швидкість зв’язування іонів Cu2+ різними за молекулярною масою фракціями очищеного препарату ФК, вилучених з природної води. Комплексоутворення досліджувалось при рН 8,0 та концентрації ФК в розчині близько 27 мг/дм3 (такі величини концентрації ФК характерні для Київського водосховища у весняний період). Виявилось, що зв’язування міді в комплекси відбувається значно швидше, ніж в пробах природної води, хоча і в цьому випадку рівновага в системі досягається лише на 5-у або 6-у добу від початку експерименту (див. рис. 6б).
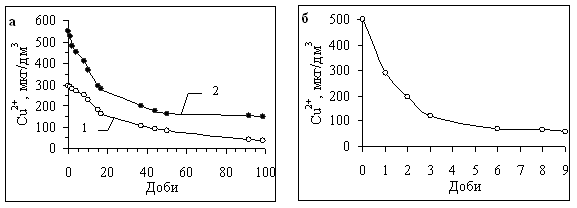
Рис. 6. Зміна концентрації вільних іонів Cu (ІІ) у воді з верхньої ділянки Канівського водосховища в червні 1998 р. (а) та в пробах на основі бідистильованої води з фракцією ФК 800–400 Да (б) внаслідок комплексоутворення. а: початкова концентрація іонів Cu (ІІ) у воді 250 (1) та 500 (2) мкг/дм3, рН=8,1; б: рН=8,0; Сорг= 27,0 мг/дм3, [Cu2+]=500 мкг/дм3.
Питання про досить незначне комплексоутворення при збільшенні концентрації ГР у водному середовищі до цих пір залишається мало вивченим. Можна припустити, що збільшення вмісту ГР у воді супроводжується певними конформаційними змінами у будові макромолекул, внаслідок чого їх активні центри стають недоступними для комплексоутворення. З іншого боку, не слід виключати того, що абсолютна більшість комплексоутворюючих центрів може бути зайнята іонами інших металів , таких як залізо, алюміній, мідь . На наш погляд, ця причина цілком аргументована, якщо врахувати, що дуже часто спостерігається тісний взаємозв’язок між кольоровістю води та вмістом в ній заліза. На прикладі Київського водосховища було виявлено, що збільшення кольоровості води призводить до зростання в ній концентрації заліза, причому таке явище спостерігається не тільки в період весняної повені, але й за умов дощового літа. Оскільки, залізо з ГР утворює досить тривкі комплекси, то конкуруюче комплексоутворення з іншими іонами металів у цьому випадку є практично неможливим. Повністю звільнити залізо з комплексних сполук вдається лише за умов жорсткого фотохімічного окислення РОР у кислому середовищі, або ультразвукової обробки проб води.
Детоксикація металів внаслідок їх зв’язування в комплекси з ГР. Комплексоутворення за участю органічних лігандів природного походження в більшості випадків супроводжується зниженням токсичності металів або повним її зникненням. Це підтверджують і результати спеціально проведених нами експериментів, метою яких було вивчення токсичності міді в довготривалих дослідах з природною водою з Канівського водосховища [10]. Токсична дія вільних іонів міді встановлювалась шляхом біотестування з використанням Daphnia magna Straus та деяких інших гіллястовусих ракоподібних (Ceriodaphnia affinis Lilljeborg і Eurycercus lamellatus O.F.Muller). Процес комплексоутворення тривав понад три місяці. Було встановлено, що токсичність водного середовища визначалась, головним чином, наявністю вільних іонів Cu (II), концентрацію яких постійно контролювали за допомогою хемілюмінесцентного методу. Зі зниженням їх вмісту за рахунок зв’язування в комплекси з РОР (див. рис. 6а, крива 1) токсичність води знижувалась. В комплексоутворенні основну роль відігравали ГР, головним чином ФК, бо 70–75 % міді було зв’язано саме з ними. Наприкінці експерименту токсичність водного середовища виявилась мінімальною, хоча сумарна концентрація розчиненої міді становила 325 мкг/дм3. Але основна частина цієї міді (300 мкг/дм3) знаходилась у складі комплексних сполук, які, судячи з усього, не проявляли токсичної дії на тест-організми.
Інші реферати на тему «Хімія»:
Значення хімії у розв’язанні сировинної проблеми
Методичний підхід до визначення якості природних вод і заходів з її поліпшення при використанні для зрошення ґрунтів чорноземного типу
Поняття про алотропію
Визначення біологічної активності стирилових похідних четвертинних солей хінолінію
Коксування вугілля
