Сторінка
2
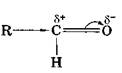
На відміну від етиленового подвійного зв'язку С=С з рівномірним розподілом електронної густини між атомами вуглецю подвійний зв'язок С=О в молекулах альдегідів полярний, що й зумовлює високу реакційну здатність речовин цього класу.
За номенклатурою, що історично склалась, назви альдегідів походять від назв тих кислот, на які вони перетворюються при окисненні: наприклад мурашиний альдегід або формальдегід,— від мурашиної кислоти, оцтовий альдегід, або ацетальдегід,— від оцтової кислоти і т.д. За систематичною номенклатурою назви альдегідів утворюють додаванням суфікса -аль до назв відповідних насичених вуглеводнів, похідними яких можна вважати альдегіди.
Як видно з наведених у таблиці 5 властивостей альдегідів, перший член ряду — мурашиний альдегід — газ, наступні гомологи — рідини, вищі альдегіди — тверді речовини. Мурашиний та оцтовий альдегіди мають різкий задушливий запах, добре розчинні у воді. Водний розчин з масовою часткою формальдегіду 40 % називається формаліном.
Хімічні властивості альдегідів зумовлені насамперед наявністю в їхніх молекулах карбонільної групи.
Реакції приєднання можливі внаслідок розриву подвійного зв'язку карбонільної групи. Приєднання водню, що відбувається при пропусканні суміші формальдегіду і водню над нагрітим каталізатором — порошком нікелю, приводить до відновлення альдегіду у спирт:
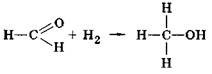
Реакції окиснення відбуваються дуже легко за місцем зв'язку С—Н, який перебуває під впливом карбонільного атома кисню. Так, при нагріванні формальдегіду з аміачним розчином оксиду срібла Ag2O (у воді оксид срібла не розчиняється) відбувається окиснення формальдегіду у мурашину кислоту НСООН і відновлення срібла:
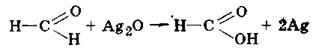
Срібло виділяється у вигляді тонкого дзеркального нальоту на стінках посудини. Ця реакція має назву реакції срібного дзеркала і є якісною реакцією на альдегідну групу. Вона використовується у промисловості для виробництва дзеркал.
Альдегіди відновлюють гідроксид міді (II) до гідроксиду міді (І), який далі перетворюється на оранжевий оксид міді (І). Реакція відбувається при нагріванні:
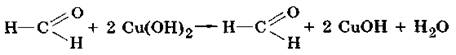
2 CuOH → Cu2O + Н2О
Цю реакцію також можна використати для виявлення альдегідів.
У загальному вигляді реакцію окиснення альдегіду можна зобразити так:
![]()
Альдегіди вступають у реакції полімеризації. При довгому стоянні формаліну можна помітити утворення білого осаду полімеру формальдегіду — параформу. Реакцію полімеризації можна зобразити схемою:
пН2С==О → (—Н2С—О—)п
Чим нижча температура, тим швидше відбувається цей процес, тому формалін не слід зберігати при температурі, нижчій за 10—12°С. У промисловості цю реакцію використовують для добування поліформальдегіду, вироби з якого є замінниками металевих деталей.
Окремі альдегіди, наприклад формальдегід, можуть вступати в реакцію поліконденсації з утворенням високомолекулярних сполук. Так, формальдегід за наявності каталізатора (кислоти або лугу) реагує з фенолом. Оскільки у молекулі фенолу атоми водню рухливі (особливо в положеннях 2, 4, 6), а карбонільна група альдегіду здатна до реакцій приєднання, то спочатку фенол і формальдегід взаємодіють між собою:
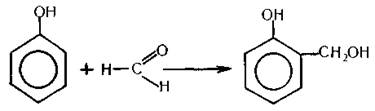
Сполука, що утворилася, взаємодіє далі з фенолом з виділенням молекули води:
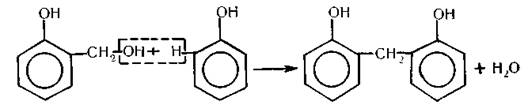
Добутий продукт взаємодіє з наступною молекулою формальдегіду, потім з молекулою фенолу і т.д. Такий спосіб добування полімеру називається реакцією поліконденсації.
Реакція поліконденсації — це процес утворення високомолекулярних речовин з низькомолекулярних, під час якого відщеплюється побічний продукт (найчастіше вода).
Як відомо, при полімеризації на відміну від поліконденсації побічні речовини не виділяються.
Застосування альдегідів. Внаслідок поліконденсації фенолу з формальдегідом утворюються феноло-формальдегідні смоли, з яких виготовляють пластмаси-фенопласти. Це — найважливіші замінники кольорових і чорних металів у багатьох галузях промисловості. З них виготовляють велику кількість виробів широкого вжитку, електроізоляційні матеріали та будівельні деталі.
Формальдегід використовують звичайно у вигляді водного розчину — формаліну. Діючи на білок, формалін робить його щільним, нерозчинним у воді і, головне, запобігає гниттю. Тому його використовують для вичинення шкур, а також для консервування анатомічних препаратів. Формалін використовують у сільському господарстві для протруювання насіння з метою знищення личинок шкідників, його застосовують також для дезинфекції приміщень, хірургічних інструментів. Взаємодією формальдегіду з аміаком добувають відому лікарську речовину уротропін.
Оцтовий альдегід застосовують головним чином для добування оцтової кислоти, а також у деяких органічних синтезах. Відновленням ацетальдегіду в деяких країнах добувають етиловий спирт.
Вищі альдегіди, які містять у молекулі від 7 до 16 атомів вуглецю, мають приємний запах і тому широко застосовуються у парфумерії.
Добування альдегідів. Загальним способом добування альдегідів є окиснення спиртів. Ми вже розглядали таку реакцію. Для ілюстрації цього способу проведемо такий дослід. Розжаримо в полум'ї спиртівки спіраль з мідної дротини й опустимо її в пробірку із спиртом. Помічаємо, що спіраль, яка вкривається при нагріванні темним нальотом оксиду міді (II), у спирті знову стає блискучою; одночасно відчуємо запах альдегіду:
